刘天慈
加好友
刘天慈 2021-10-21
作者:李昱儒 雷雪 郑成霞 叶绿体是高等植物和一些藻类特有的双膜细胞器,具有自己的基因组,能够行使“半自主”的权力。作为植物的“养料制造车间”,它们是如何应对植物生长发育和环境变化过程中的种种挑战,维持自身基因组的稳定性以顺利运转?奥秘竟然在于一种特殊的三链核酸结构R-loop,它能够调控半自主细胞器的基因组稳定性。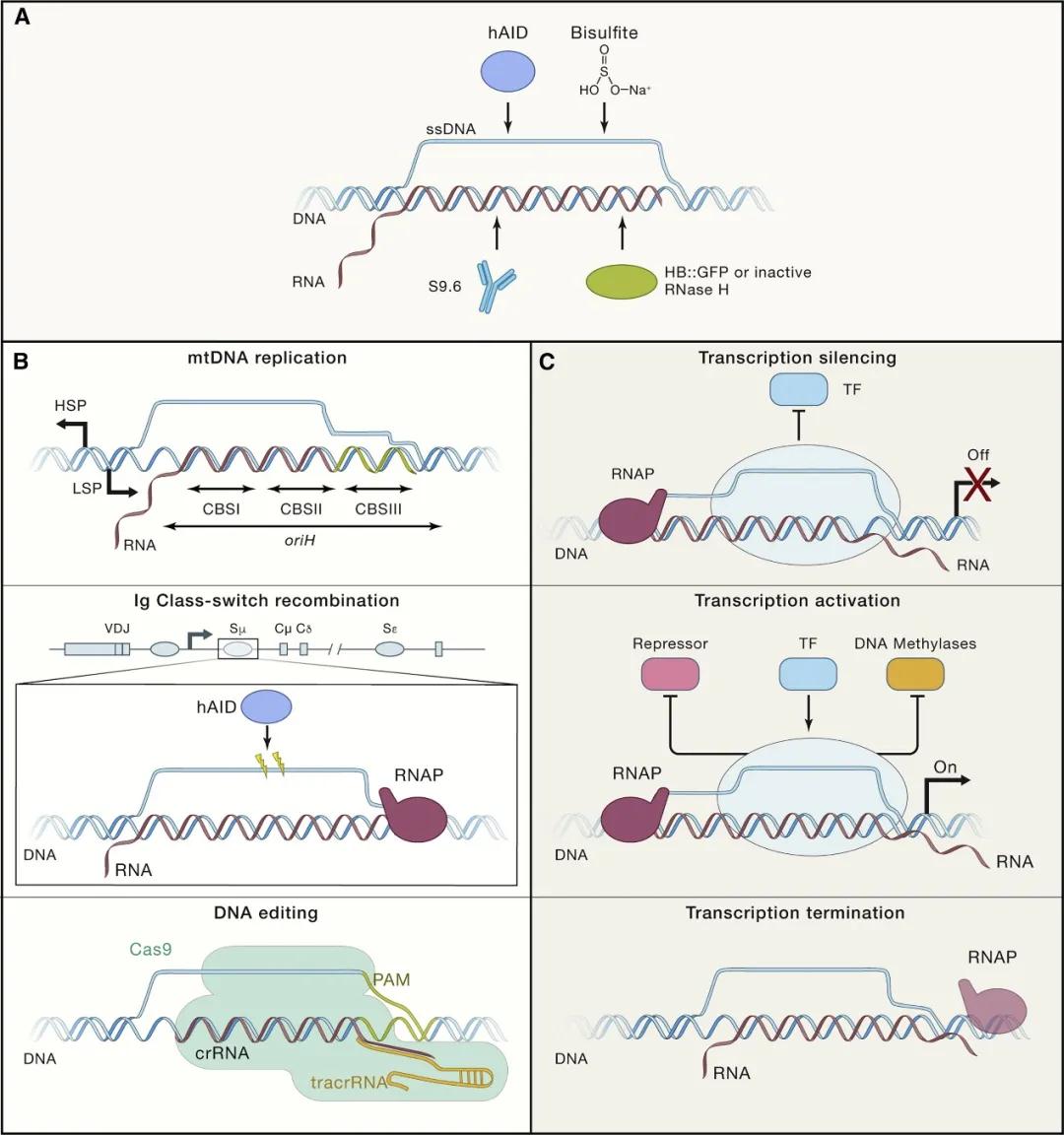
图1. R-loop的结构及功能
R-loop是一种由单链DNA和DNA:RNA杂合链组成的特殊三链核酸结构,广泛存在于各个物种中,最初被认为是转录过程中的副产物,但越来越多的研究证明其在基因表达调控、DNA损伤修复、染色质修饰和维护基因组稳定性等生物学过程中都发挥着重要的功能(图1)。孙前文课题组主要关注R-loop的形成、稳定和解除的调控机制及相应的生物学功能,并取得了一系列重要的研究成果。该课题组2013年在Science发文报道了R-loop调节长非编码RNA表达并影响拟南芥开花的分子机制;2017年在Molecular Plant 发文首次揭示了R-loop是影响生长素极性运输和植物根发育的重要因子;同年在The Plant Cell发文报道了R-loop影响叶绿体基因组稳定性的调控机制;并且在Nature Plants上发文报道了一种高效的全基因组R-loop检测技术— ssDRIP-seq。
2020年,孙前文课题组在Cell Reports发文揭示了拟南芥中DNA:RNA解旋酶RHON1与AtRNase H1限制转录-复制正面对撞导致的R-loop积累从而稳定叶绿体基因组的分子机制;同年在The Plant Cell发文报道拟南芥在不同发育时期以及各种胁迫响应下的R-loop图谱,并揭示了拟南芥R-loop特有的动态变化特征。2021年,该课题组在Nucleic Acids Research上发文证实了AtRNH1C与单链DNA结合蛋白WHY1/3和重组酶RecA1在共同维持叶绿体基因组完整性过程中发挥着举足轻重的作用;随后,在PLoS Biology上发文报道了AtRNH1C叶绿体和线粒体的兼性双定位特征,并揭示线粒体中R-loop的调控机理和生物学功能。最近,该课题组又在The Plant Cell上发文报道了植物基因内tRNA形成的R-loops通过调控RNA聚合酶II和III之间的转录干扰以应对氧化胁迫。这些成果加深了我们对R-loop功能的理解,并为后续的相关研究提供了重要的理论依据。
在这里,我们主要为大家介绍植物维持叶绿体基因组稳定性的机制。叶绿体作为植物细胞中负责“养料制造”和“能量转换”的半自主细胞器,精确调控R-loop的形成和清除对其维持自身基因组稳定性及正常行使功能至关重要[2]。为了更好地理解半自主细胞器叶绿体和线粒体中R-loop形成和清除的机制和其生物学功能,孙前文课题组开展了一系列的研究工作。
AtRNH1C与AtGyrase互作限制R-loop积累,缓解转录复制对撞
R-loop的清除主要由核糖核酸酶RNase H来完成,RNase H可以特异地消化DNA:RNA杂合链中的RNA。首先,通过比对不同物种间的RNase H1蛋白序列,确定了拟南芥中存在三种RNase H同源蛋白:AtRNH1A,AtRNH1B,AtRNH1C。AtRNH1A定位于细胞核,AtRNH1B定位于线粒体,而AtRNH1C主要定位于叶绿体。与野生型植株Col-0相比,AtRNH1C的突变体atrnh1c有明显的植株矮小和叶片黄化表型,叶绿体发育和功能出现异常。利用可以特异识别R-loop的抗体S9.6, AtRNH1C蛋白被证实具有明显的RNase H活性,可以降解R-loop,而AtRNH1C蛋白功能缺失后,植株体内的R-loop水平显著高于野生型。此外, 检测基因组稳定性的PFGE实验结果也显示在atrnh1c中有大量降解的DNA。上述结果说明,AtRNH1C这一叶绿体定位的RNase H1蛋白通过对R-loop的调控,维持叶绿体正常发育及其基因组稳定性。
为了进一步探究AtRNH1C发挥作用的机制,孙前文课题组通过质谱找到了与AtRNH1C相互作用的一系列蛋白。其中一类DNA促旋酶AtGyrases蛋白表达受到抑制后会严重影响叶绿体的发育甚至出现致死。CO-IP实验揭示AtRNH1C与AtGyrases之间以一种依赖于DNA或RNA的方式相互作用,有可能是通过R-loop结构进行的。CIP可以特异的抑制AtGyrases蛋白的活性,通过检测发现,atrnh1c在rDNA区域积累了大量的R-loop,其基因组完整性降低,复制中间产物增加,而CIP抑制AtGyrases蛋白的活性后,上述情况显著加剧,atrnh1c的叶绿体和植株发育缺陷表型也进一步加重。
这表明AtRNH1C与AtGyrase的叠加作用限制R-loop的水平,缓解叶绿体基因组上高度转录和DNA复制启动的rDNA区域中的冲突,维持基因组的完整性,保证叶绿体的正常发育(图2)。该工作详细地揭示了叶绿体如何调节基因组的稳定性,有助于加深人们对半自主细胞器发育调控的认识[3]。

图2. AtRNH1C和AtGyrases活性影响叶绿体基因组稳定性
RHON1协调PEP转录活性并移除叶绿体R-loop
在叶绿体中,除了RNase H蛋白,是否还有其它的蛋白参与调控R-loop的水平?尽管atrnh1c突变体发育严重受损,但其依然可以正常繁殖,这表明可能有一条替代途径来抵抗atrnh1c叶绿体中积累的R-loop。参与转录调控和RNA加工的蛋白是调控R-loop的关键因子,它们作用于新产生的RNA,促进其加工,防止其与DNA模板链配对。通过在atrnh1c植株中过表达一些已知的RNA加工过程调节因子,我们发现过表达RHON1可以明显地回补atrnh1c突变体的矮小和黄化,以及叶绿体发育的异常表型。
RHON1是一个叶绿体定位的RNA加工调节因子,与叶绿体RNA的成熟有关,rhon1突变体与atrnh1c突变体具有相似的表型。我们在rhon1突变体中过表达AtRNH1C,同样回补了rhon1突变体的异常表型。比起各自的单突变体,杂交或基因敲除得到的rhon1/atrnh1c双突变体表现出更加严重的矮小和白化表型,并且叶绿体发育更加异常。细菌中的同源物Rho作为解旋酶,能够从DNA:RNA杂交链中释放RNA,参与转录终止过程。EMSA等体外实验表明,只有完整的RHON1蛋白才能够结合在DNA:RNA杂合链上,并且只有R-loop上的RNA链具有游离的5’端以及存在ATP供能时,RHON1蛋白才会表现出解旋酶的活性。通过质谱分析,质体编码的RNA聚合酶PEP被发现是RHON1的互作蛋白。进一步研究发现RHON1与PEP相互作用,通过协调PEP的转录活性,缓解基因组上转录复制对撞之间的冲突,同时限制和移除叶绿体基因组上形成的R-loop结构,进而维持基因组稳定。这一研究结果表明,生物体内存在多种机制来缓解转录复制冲突诱发的R-loop积累(图3)[4]。

图3. RHON1是一条与AtRNH1C途径相平行的R-loop移除通路
AtRNH1C参与拟南芥叶绿体中的DNA损伤修复
除了AtGyrases这一互作蛋白外,单链DNA结合蛋白WHY1/3也与AtRNH1C有潜在的相互作用,而WHY1/3已被证实在DNA断裂修复过程中起非常重要的作用。为此我们探究了AtRNH1C和R-loop参与DNA断裂修复的可能性。真核生物的重组酶Rad51和细菌的重组酶RecA参与调控同源修复过程,在植物中,定位于叶绿体的RecA1是它们的同源蛋白。我们发现在正常条件下, RecA1以丝状的形式存在,而在R-loop积累的atrnh1c突变体中RecA1则由丝状变为点状。这说明R-loop的积累可能抑制RecA1丝状体的形成,暗示在叶绿体中,AtRNH1C对R-loop的作用可能与DNA双链断裂的同源重组修复有关。
于是我们创造了AtRNH1C,WHY1/3,RecA1相关的各种突变体,用这一系列遗传材料来探究AtRNH1C,WHY1/3,RecA1三者之间的关系。结果发现,AtRNH1C的缺失(R-loop的积累)不仅使重组酶RecA1在叶绿体中的排布由丝状变为点状,并且抑制WHY1/3在叶绿体DNA断裂位点的积累。WHY1/3与AtRNH1C相互作用,且被招募到相同的基因组位点以促进同源重组。AtRNH1C或WHY1/3的缺失会显著抑制质体编码的RNA聚合酶(PEP)结合到DNA断裂位点,从而抑制同源重组(HR)并促进微同源介导的双链断裂修复(MMBIR)。随后的遗传学实验证实DNA聚合酶Pol IB与AtRNH1C共同参与DNA损伤修复过程(图4)。该工作证实了R-loop在促进同源重组修复和叶绿体细胞器发育过程中的积极作用,揭示了RNase H1蛋白AtRNH1C与单链DNA结合蛋白WHY1/3和重组酶RecA1在共同维持叶绿体基因组完整性过程中发挥着重要作用[2]。
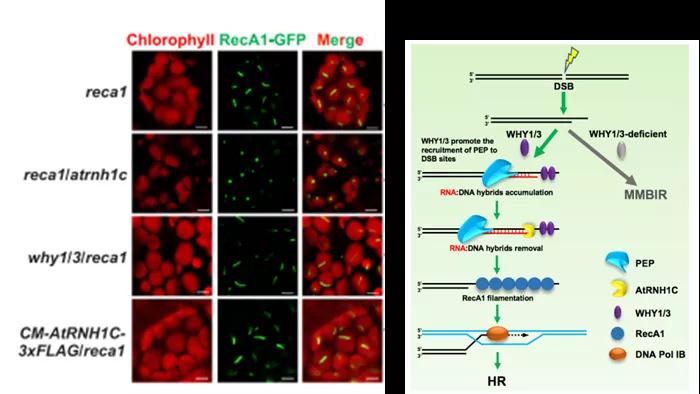
图4. RNA:DNA hybrids介导叶绿体基因组损伤修复的分子机制模型
RNase H1的细胞器间双向靶向机制在基因组维护和胚胎发生中的作用
我们发现另一个有趣的现象是AtRNH1C并不仅在叶绿体中发挥作用,在特定环境下还能穿梭至线粒体中发挥功能。这个发现起源于对线粒体定位的AtRNH1B的研究。AtRNH1B蛋白具有明显的RNase H1活性,并且在胚胎发育过程有较高的表达,但是atrnh1b突变体并没有表现出异常的表型。随后我们通过杂交获得了atrnh1b/c双突变体(atrnh1b纯合,atrnh1c杂合),发现其部分种子是败育的。基因型鉴定发现,败育的种子均为atrnh1b/c纯合双突。电镜观测发现败育种子的胚胎发育异常,且线粒体发育严重受损,暗示AtRNH1B和AtRNH1C蛋白可能存在功能冗余。那么定位于叶绿体中的AtRNH1C如何在线粒体中发挥作用呢?我们在野生型和atrnh1b突变体背景下观察AtRNH1C的定位,发现在atrnh1b突变体中,AtRNH1C会出现在线粒体中。这说明在AtRNH1B蛋白缺失的情况下,部分AtRNH1C可以从叶绿体进入线粒体发挥作用。
接下来,我们探究了正常条件下限制AtRNH1C转移的机制。我们比对了AtRNH1B和AtRNH1C蛋白的序列,选择了两个序列差异较大的位点进行验证。通过用不同组合的片段与GFP组成融合蛋白,并在原生质体中瞬时转化,我们确定了只有在AtRNH1C蛋白的第69位到第77位这9个氨基酸缺失的情况下,AtRNH1C才会从叶绿体进入线粒体。植物线粒体基因组富含可以介导异位同源重组的重复序列,那么线粒体定位的RNase H1蛋白是否参与调控这一过程呢?进一步的研究发现,atrnh1b/c双突变体的胚胎早期发育停滞是由于过量的R-loop的积累而引起线粒体频繁的异位同源重组所导致的,同时伴随同源重组中间产物的增加和线粒体DNA拷贝数的减少,而且同源重组的关键因子OSB1可以通过抑制R-loop形成以限制mtDNA的同源重组过程(图5)。该工作提供了对发育过程中线粒体基因组维持的新见解,并揭示了半自主细胞器之间交流的新机制[5]。
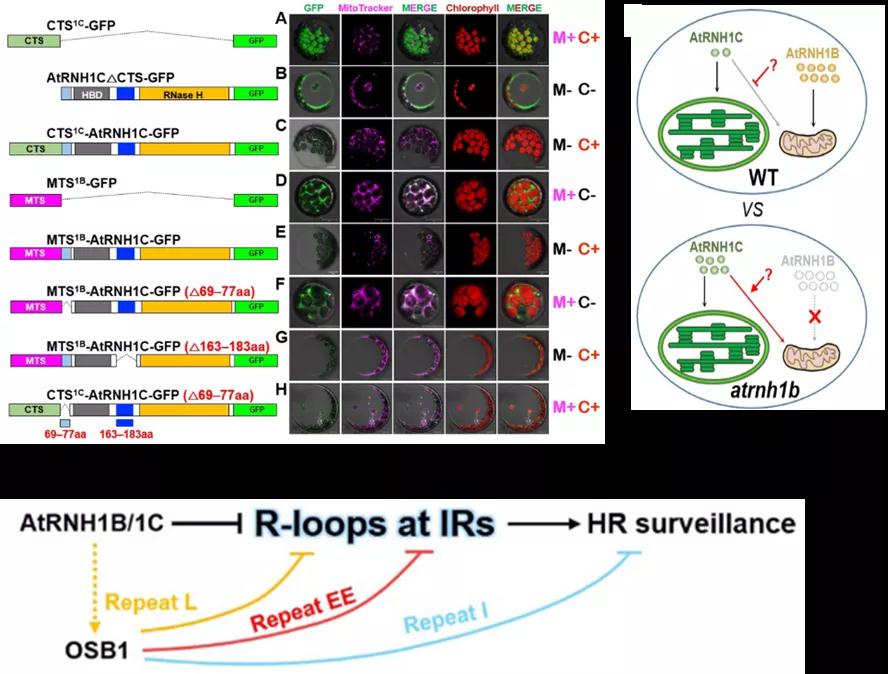
图5.拟南芥半自主细胞器之间可进行相互交流
综上,植物为了保障叶绿体能够正常发挥生理功能,组建了一个精细的调控网络,对生长发育和环境变化过程中产生的R-loop进行高效调节,例如通过AtRNH1C降解R-loop中的RNA,以及通过解旋酶RHON1移除R-loop,应对转录复制冲突导致的R-loop积累以稳定叶绿体基因组,使得这些绿色的“养料制造车间”得以有条不紊地运转。这对其他物种中R-loop的调控研究也具有一定的借鉴意义。
此外,作为一种典型的半自主细胞器,叶绿体基因组的稳定性是细胞基因表达调控中不可或缺的一部分。我们已经知道半自主细胞器和核基因组中的基因能够互相转移,而AtRNH1B蛋白缺失的情况下部分AtRNH1C可以改变靶向的“目的地”进入线粒体发挥作用的发现,则揭示了一种细胞器间紧密交流的新颖机制,这启示我们核基因组、线粒体基因组和叶绿体基因组并不是三足鼎立、各自为政,而是紧密联系在一起的。随着测序技术和研究方法的快速发展,人们对叶绿体基因组的认识不断加深,其应用价值也愈发凸显:例如通过对叶绿体基因组结构和序列的解析比较,揭示植物系统发育中的物种起源和进化;利用叶绿体基因多拷贝的特性,进行叶绿体遗传转化,从而大量生产生物制剂或进行农艺作物性状改良等。
参考文献:
[1] Garcia-Muse, T. & Aguilera, A. R Loops: From Physiological to Pathological Roles. Cell 179, 604-618 (2019).
[2] Wang W, Li K, Yang Z, Hou Q, Zhao WW, Sun Q. RNase H1C collaborates with ssDNA binding proteins WHY1/3 and recombinase RecA1 to fulfill the DNA damage repair in Arabidopsis chloroplasts. Nucleic Acids Res. 9;49(12):6771-6787 (2021).
[3] Yang, Z. et al. RNase H1 Cooperates with DNA Gyrases to Restrict R-Loops and Maintain Genome Integrity in Arabidopsis Chloroplasts. Plant Cell 29, 2478-2497 (2017).
[4] Yang, Z., Li, M. & Sun, Q. RHON1 Co-transcriptionally Resolves R-Loops for
特别声明:本文转载仅仅是出于传播信息的需要,并不意味着代表本网站观点或证实其内容的真实性;如其他媒体、网站或个人从本网站转载使用,须保留本网站注明的“来源”,并自负版权等法律责任;作者如果不希望被转载或者联系转载稿费等事宜,请与我们接洽。
基因组 DNA 线粒体 调控 线粒体dna 细胞器 突变理论 叶绿体 rna干扰
植物线粒体DNA实现首次编辑
演化:“最奇怪动物”身份揭秘
发现线粒体DNA突变引发肠衰老机制与逆转方案

细菌毒素让精准编辑线粒体DNA成为现实
孙前文实验室发现拟南芥半自主细胞器间的交流可保障R-loop调控线粒体基因组稳定性的全新机制
为何生物的线粒体DNA只来自母亲

拟南芥半自主细胞器间的交流可保障R-loop调控线粒体基因组稳定性的全新机制

三手烟有损细胞DNA和线粒体
线粒体DNA荧光成像新策略
首次发现没有基因组DNA的线粒体,这种生物的进化,走在了所有生命的前面