科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2022-01-11
2022年1月5日,中国科学院广州生物医药与健康研究院王建华课题组和陈凌课题组合作,揭示调控HIV潜伏的重要细胞信号通路,发现能够高效激活潜伏HIV的小分子化合物,并提示该化合物可用于HIV潜伏根治手段。相关研究成果以Pharmacological suppression of glycogen synthase kinase-3 reactivates HIV-1 from latency via activating Wnt/β-catenin/TCF1 axis in CD4+ T cells为题,发表在Emerging Microbes & Infections上。
HIV作为逆转录病毒,其基因组逆转录为DNA后可整合到宿主基因组中,建立潜伏感染。CD4+ T细胞是HIV主要潜伏细胞;在组织解剖学上,肠系膜淋巴结、肠黏膜组织、生殖道黏膜组织及中枢神经系统等是HIV主要“藏匿”位点。这些潜伏的HIV不能被抗逆转录病毒药物治疗(ART)清除,这是当前实现HIV/AIDS根治的主要难点之一。目前,“激活-杀灭”模式(Shock and Kill)是为实现根治HIV/AIDS而重点研发的策略之一,即利用潜伏激活剂(LRA)激活潜伏的HIV,从而“引蛇出洞”,然后联合ART或细胞免疫治疗杀灭激活的病毒或感染细胞,以达到清除潜伏病毒的目的。多种LRAs如蛋白激酶C(PKC)通路激活剂及表观遗传学修饰调节剂等正处于临床试验阶段。然而,由于HIV潜伏复杂调控机制,这些LRA在体内未显示出高效的潜伏激活效果。
HIV/AIDS根治策略的发展亟待HIV潜伏机制的深入剖析。王建华团队前期对HIV潜伏调控机制进行系统研究,发现多种调控HIV潜伏的关键宿主靶点,例如,色氨酸代谢产物可通过激活芳香烃受体(AHR)信号通路激活潜伏的HIV(mBio 2019);宿主蛋白RBMX(mBio 2020)、SUN2(mBio 2018)、SAFB1(Journal of Biological Chemistry 2018)、Naf1(Journal of Virology 2017)及长链非编码RNA MALAT1(Nucleic Acids Research 2019)是调控HIV潜伏的重要宿主因子。科研团队针对这些调控HIV潜伏的关键宿主靶点,研发能够激活潜伏HIV的LRAs。
研究发现,小分子化合物6-BIO可高效激活CD4+ T细胞中潜伏的HIV,并利用SIV(猴免疫缺陷病毒)感染的恒河猴模型评价了6-BIO激活潜伏病毒的效果。研究提示,6-BIO可作为高效的LRA联合ART或细胞免疫治疗,适用于“激活-杀灭”策略,用于HIV潜伏根治。6-BIO,汉语名字是(2ˊZ,3ˊE)-6-溴靛玉红-3ˊ-肟,英文名字是6-Bromoindirubin-3-acuteoxime,分子式是C16H10BrN3O2,是从环带骨螺中分离出的紫靛玉红染料的衍生物。
该研究剖析了6-BIO激活CD4+ T细胞中潜伏HIV的机制。研究发现,6-BIO通过抑制细胞内GSK-3(糖原合成酶激酶-3)激活细胞内Wnt/β-catenin/TCF1信号通路。该通路的激活可导致转录因子TCF1募集至HIV启动子LTR区域,并改变LTR区域组蛋白表观遗传学修饰,从而驱动HIV前病毒DNA转录和激活潜伏病毒。
研究工作得到国家自然科学基金与中科院的支持。上海巴斯德研究所、郑州市第六人民医院、河南师范大学、中山大学参与研究。
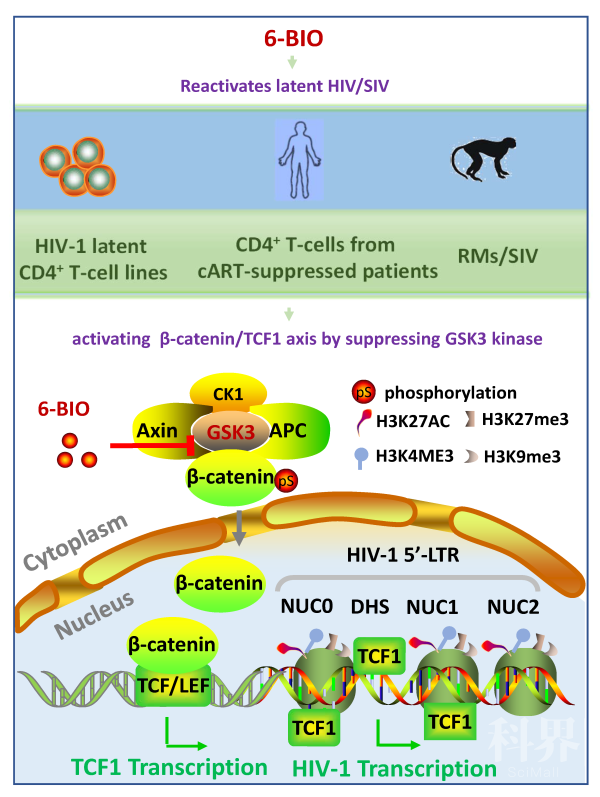
论文总结图:6-BIO激活CD4+ T细胞中潜伏的HIV。利用HIV潜伏感染的CD4+ T细胞系、HIV感染治疗病人中分离的HIV潜伏的CD4+ T细胞及SIV感染的恒河猴模型,证明小分子化合物6-BIO可高效激活潜伏的HIV。分子机制上,6-BIO通过抑制CD4+ T细胞内糖原合成酶激酶-3(GSK3)激活Wnt/β-catenin/TCF1信号通路,促使TCF1募集至HIV启动子LTR区域,并改变LTR区域组蛋白表观遗传学修饰,从而驱动HIV前病毒DNA转录和激活潜伏病毒。
来源:中国科学院
原文链接:http://www.cas.cn/syky/202201/t20220107_4821070.shtml
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
《自然》发文:麻省理工学院发现海洋中一种未知病毒
宇宙可能到处都是外星病毒,或成发现外星人首个迹象

潜伏HIV被重新激活的方式

解决领域多年的难题!多胺代谢是控制 CD4+ 辅助 T 细胞极化为不同功能命运的亚群细胞
中科院找到可高效激活潜伏HIV小分子化合物

病毒,不单单是“祸害”

艾滋病疫苗为何“难产”?

新艾滋病病毒限制因子确定,离消除HIV潜伏期更近一步

糖基特征识别,揪出隐藏的HIV病毒

胡德庆/高欣联合团队揭示HIV潜伏感染与复制的表观遗传与转录调控机制