科技工作者之家
科界APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-01-31
来源:CBG资讯
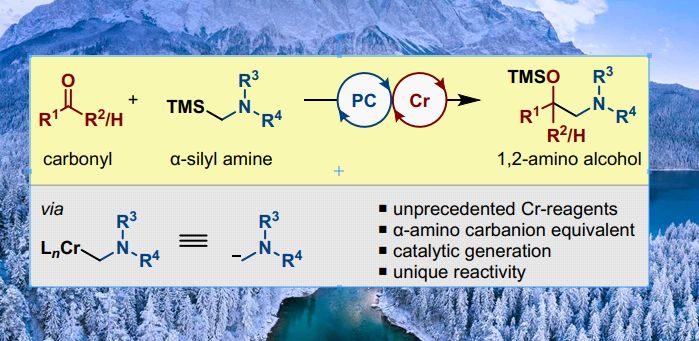
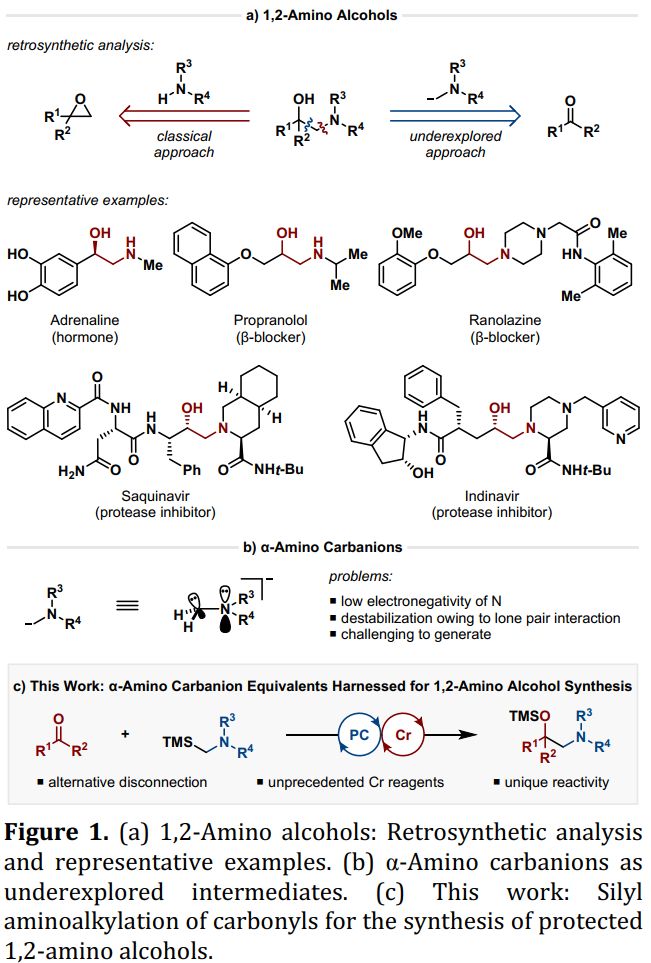
1,2-氨基醇单元是一类重要的基团,广泛存在于天然产物、药物活性分子及配体结构中。据估计,大约有300000个化合物具有这个单元,其中有>2000个天然产物,>80个FDA批准的药物和>100个候选药物(Figure 1)。因此,这类结构的合成引起了化学工作者的广泛兴趣。在传统方法中,可以采用胺类化合物对环氧结构进行亲核进攻得到此类产物,但环氧化合物活性太高且难以制备,因此这种方法的选择性不高。另一种方法则是采用碳负离子对羰基亲核加成得到此类产物,然而这种方法发展较缓慢,主要是由于α-氮取代的碳负离子难以合成(α-氮原子对碳负离子具有去稳定化作用)。目前,合成α-氮取代的碳负离子的方法主要依赖于锡试剂,但这种方法毒性较大、原子经济型低、官能团耐受性差。
有机铬试剂作为亲核试剂具有独特的优势,铬试剂不仅官能团耐受性较好,而且对于醛类化合物有着良好的选择性。因此,有机铬试剂对羰基的加成反应,即Nozaki-Hiyama-Kishi(NHK)反应,被广泛应用于有机合成中,。虽然许多铬试剂可以采用传统NHK反应的条件生成(即镍催化的有机卤代物与铬物种的还原金属化反应),然而,烷基铬试剂合成却较难。Takai、Shenvi和Baran课题组分别发展了合成烷基铬试剂的方法,这大大扩展了铬介导的羰基官能团化反应的底物范围。然而,这些方法中仍然需要当量的铬盐,同时,α-氨基烷基铬物种无法用这些方法合成。最近,德国明斯特大学的Frank Glorius课题组发展了一种催化的方法来合成α-氨基烷基铬物种,为1,2-氨基醇的合成提供了一种简单、温和的合成方法。相关研究成果发表在J. Am. Chem. Soc.上(DOI: 10.1021/jacs.9b12053)。
(来源:J. Am. Chem. Soc.)
首先,作者采用苯丙醛1a与α-硅基胺2a为模板底物进行条件优化(Table 1)。通过对光敏剂、铬盐等条件的优化,作者确定了反应的最优反应条件为:[Ir(dF(CF3)ppy)2(dtbbpy)][PF6](Ir-2)为光敏剂、三氯化铬为铬盐、DMA为溶剂,底物于蓝光照射下室温反应2 h,最终以92%的收率得到产物。值得一提的是,反应对于水分敏感,但是光照强度、温度和反应浓度等条件对于反应体系影响较小。

(来源:J. Am. Chem. Soc.)
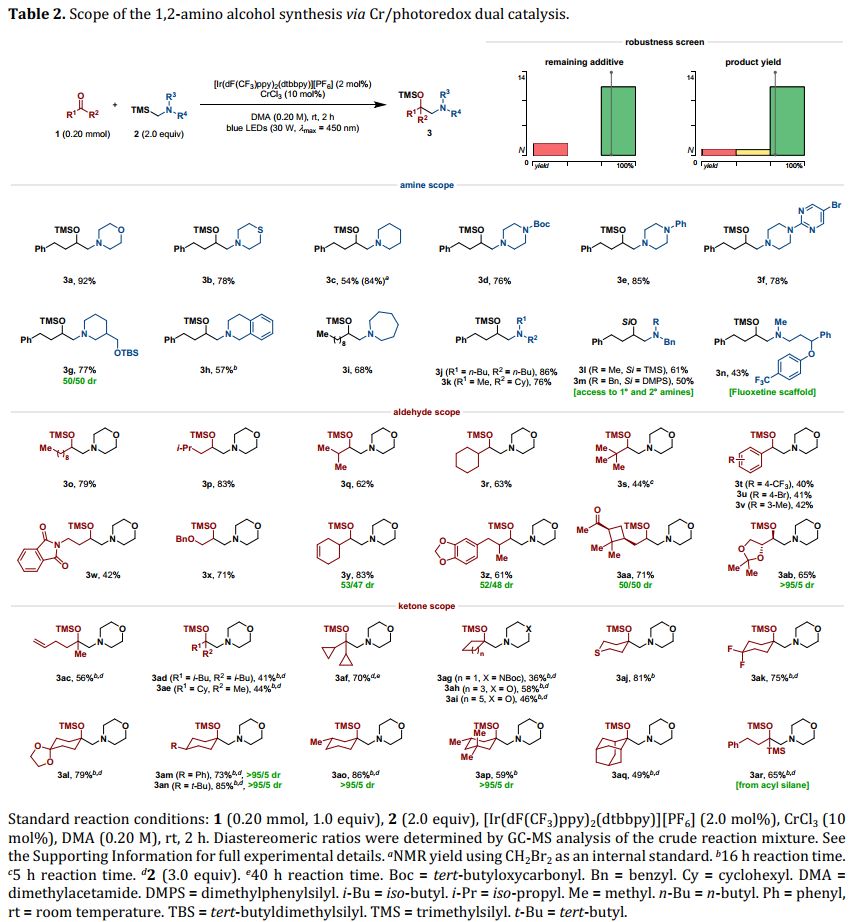
确定最优反应条件后,作者随后对反应的底物范围进行了扩展(Table 2)。许多氮杂环结构均能很好地参与到反应中,环的大小对于反应影响较小,开环的胺类化合物也能以高收率得到产物。但是,二级α-氨基烷基铬试剂不能有效参与到反应中。对于芳香醛底物,只能以中等收率得到产物,这主要是由于反应产生了频哪醇偶联的产物。该反应具有良好的官能团耐受性,三级胺、烯烃、芳基卤代物等基团均能兼容反应条件。同时,反应体系对于醛类化合物与酮类化合物具有良好选择性。
随后,作者又实现了酮类化合物的烷基化这一挑战性的过程。环状、非环状及酰基硅结构均能很好地参与到反应中。
(来源:J. Am. Chem. Soc.)
最后,作者通过对反应的机理研究,得到以下结论:1)反应经还原淬灭过程;2)反应体系中经σ-键复分解过程产生α-氨基烷基铬试剂。
小结:Frank Glorius课题组采用铬/光协同催化的方式,发展了一种温和、选择性高的方法来合成α-氨基烷基铬试剂,从而实现了1,2-氨基醇的合成。
来源:BeanGoNews CBG资讯
原文链接:https://mp.weixin.qq.com/s?__biz=MzI4ODQ0NjUwMg==&mid=2247498893&idx=2&sn=e1df735dc1658bc8c1cd6beaa365230c&chksm=ec3cfdc4db4b74d2a415228bda42f2c1cac398a71faebb0801fb65d0fd8a7baf5ae768f95a6c#rd
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

李庆阁:优化"产学研用"合作机制,实现新技术与产业化无缝对接
气相中单核羰基铼配合物研究取得进展
二羰基环戊二烯基钴
烷氧羰基化
羰基氰对三氟甲氧基苯腙
硅烷化试剂
N-苄氧羰基-DL-缬氨酸
除水垢试剂
N-叔丁氧羰基-乙烯二胺

【有机】Green Chem.:三乙基硼氢化锂介导的羰基化合物的硼氢化反应