科技工作者之家
科界APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-02-03
来源:BioArt
撰文 | 十一月
许多动物在睡眠过程中是保持静止不动的状态的,肌电图活性降低是鉴定动物是否进入睡眠状态的重要标准之一【1-4】。动物脑部的觉醒状态与运动状态是相互影响的。但是脑部状态与运动活性之间相互协调以及其中具体的协调机制研究并不清楚。
2020年1月24日,美国加州大学伯克利分校Yang Dan研究组在Science上发文A common hub for sleep and motor control in the substantia nigra,发现动物的睡眠-清醒之间的脑部状态由黑质网状部(substantia nigra pars reticulata, SNr)中共同的神经元GAD2神经元所控制,GAD2神经元是睡眠与运动环路控制的中枢。

目前关于睡眠与运动状态之间相互协调关系方面了解的并不多,睡眠方面已经有所了解的是快速眼动(Rapid eye movement,REM)睡眠期间肌张力缺失【5】。既然运动状态与睡眠状态之间涉及到的神经元广泛而复杂,动物体内最有效的神经环路控制的方式应该就是共享控制神经元。而在黑质网状部区域中GABAergic神经元在运动抑制【6】以及刺激多个觉醒神经元【7】中发挥着重要的作用。由此,作者们希望进一步探究该区域中GABAergic神经元是否参与到脑部状态转换以及协调调控当中。
为了对小鼠脑部状态以及运动状态进行特点分类作者们使用家庭笼(Home cages)并基于脑电波 (EEG) 、肌电波 (EMG) 以及视频记录的方式对小鼠整个生活过程进行记录和监控。
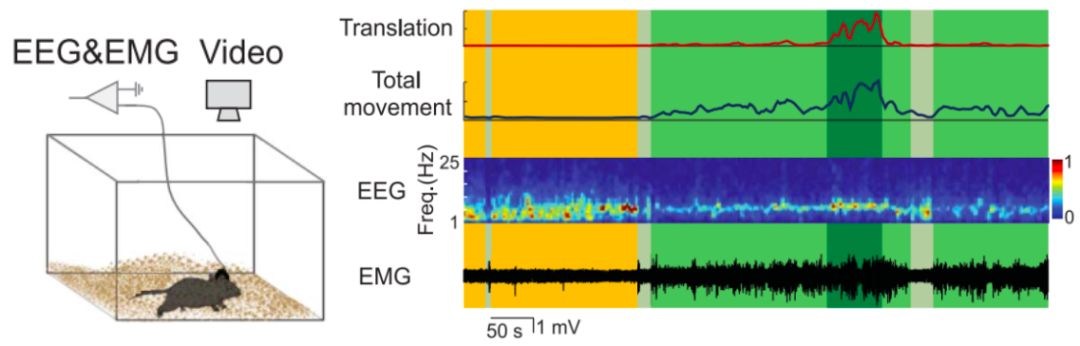
图1 对小鼠进行EEG、EMG以及视频记录的示意图以及数据图
通过对小鼠在家庭笼中的身体移动等数据进行检测后,可以将身体移动分为三个类别:运动状态(Locomotion,LM)、非运动移动状态(Nonlocomotor movement, MV)以及不移动状态。非运动移动状态指的是小鼠进食、刷洗梳毛以及姿势调整等动作,不涉及位置的移动。而不移动状态基于脑电波以及肌电波数据又可以分为两类:安静的清醒状态(Quiet wakefulness, QW)以及睡眠状态 (Sleep, SL) 。LM、MV、QW以及SL这四个状态代表了运动活性逐渐下降,肌电波活性降低而脑电波δ波段的增加(图2)。而且几乎所有的四个状态之间的转化都是两个相邻状态之间的转换,而不太会出现大的状态跳跃(图2)。
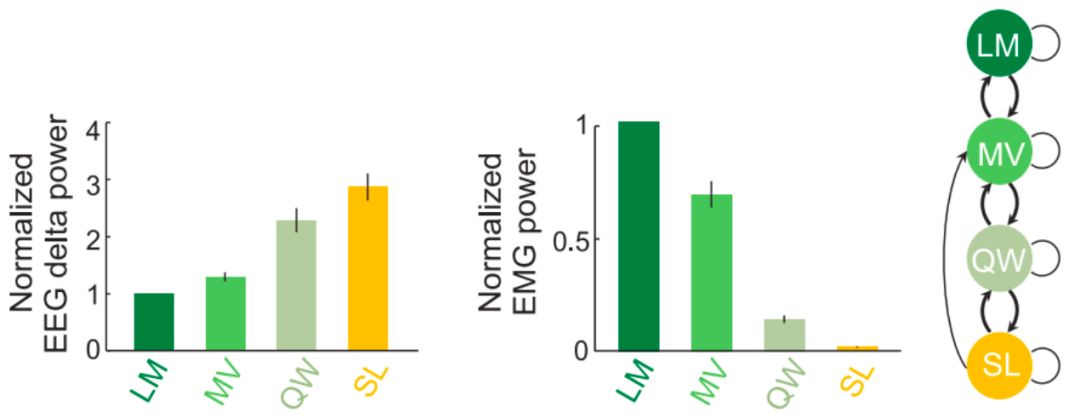
图2 小鼠家庭笼实验中不同的睡眠-运动状态以及过渡过程
进一步地,作者们检测了SNr区域中神经元在不同状态以及不同状态转化过程中的变化。前人通过单细胞基因表达分析发现在SNr中两个单独的区域存在两种GABAergic神经元群:PV(Parvalbumin)神经元以及GAD2(Glutamic acid decarboxylase 2)神经元【8】。作者们通过光遗传学等实验发现,GAD2神经元的失活会增加运动状态和不移动运动状态并且会大大降低睡眠。而GAD2光遗传激活会造成运动状态的终止以及睡眠状态的起始。而PV神经元虽然也会降低小鼠的运动状态的活性,但是却完全不会影响小鼠的睡眠状态。激光的持续激活GAD2神经元会增加LM-MV、MV-QW以及QW-SL的过渡和转换,而且相反方向的转换被大大抑制。
总的来说,Yang Dan研究组的工作向我们揭开了黑质网状部中GAD2而非PV神经元会促进睡眠的产生尤其是非快速眼动睡眠的起始,而PV神经元的激活主要作用于运动状态的终止。LM-MV-QW-SL整个行为顺序的进行是由GAD2神经元的激活而促进的,GAD2神经元的激活会引起运动活性的持续降低以及脑电波δ波段的增加,因而确认黑质中GAD2神经元是控制睡眠与运动的中枢。
原文链接:
https://science.sciencemag.org/content/367/6476/440.long
参考文献
1. Campbell, S. S. & Tobler, I. Animal sleep: a review of sleep duration across phylogeny. Neurosci Biobehav Rev 8, 269-300, doi:10.1016/0149-7634(84)90054-x (1984).
2. Hendricks, J. C. et al. Rest in Drosophila is a sleep-like state. Neuron 25, 129-138, doi:10.1016/s0896-6273(00)80877-6 (2000).
3. Shaw, P. J., Cirelli, C., Greenspan, R. J. & Tononi, G. Correlates of sleep and waking in Drosophila melanogaster. Science 287, 1834-1837, doi:10.1126/science.287.5459.1834 (2000).
4. Liu, D. & Dan, Y. A Motor Theory of Sleep-Wake Control: Arousal-Action Circuit. Annu Rev Neurosci 42, 27-46, doi:10.1146/annurev-neuro-080317-061813 (2019).
5. Peever, J. & Fuller, P. M. The Biology of REM Sleep. Curr Biol 27, R1237-R1248, doi:10.1016/j.cub.2017.10.026 (2017).
6. Kravitz, A. V. et al. Regulation of parkinsonian motor behaviours by optogenetic control of basal ganglia circuitry. Nature 466, 622-626, doi:10.1038/nature09159 (2010).
7. Ma, C. et al. Sleep Regulation by Neurotensinergic Neurons in a Thalamo-Amygdala Circuit. Neuron 103, 323-334 e327, doi:10.1016/j.neuron.2019.05.015 (2019).
8. Saunders, A. et al. Molecular Diversity and Specializations among the Cells of the Adult Mouse Brain. Cell 174, 1015-1030.e1016, doi:10.1016/j.cell.2018.07.028 (2018).
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652480504&idx=4&sn=6ff8f29c77ba66813edce76780eaff40&chksm=84e2304cb395b95a91cd18dc5f67ec94e4fd424d6122a0a2271dd23d73b57e53cfe7c666cd69&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
第二十一届全国发明展览会创客论坛成功举办




《Cell》神经元诱导干细胞重生
陈荣清/彭碧文/王云/朱沛旻 共同主持专刊 | 非神经元细胞对神经元的调节
揭秘癌细胞与神经元的“共生共舞”

新型孕妇用药测试平台:干细胞重新编程神经元
星形胶质细胞首次转为功能性神经元

人类大脑有多少个神经元细胞
脑损伤激活胶质细胞产生神经元研究获进展
大脑“后勤”细胞参与指挥神经元发育

6个字教你学会心肺复苏