科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2022-12-27
论文链接
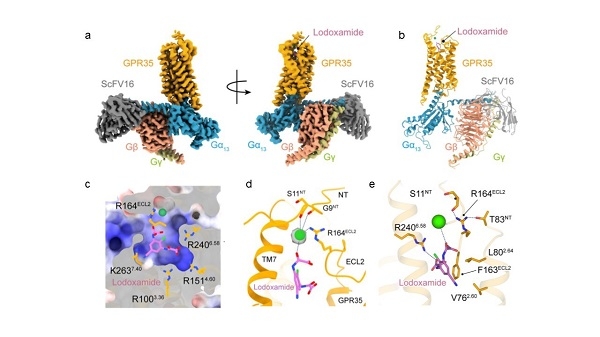
图1 a-b.洛度沙胺与GPR35和G13蛋白复合物结构;c.GPR35的极性正电结合口袋;d.二价离子与受体以及洛度沙胺的相互作用界面;e.GPR35与洛度沙胺的相互作用界面细节。
来源:中国科学院
原文链接:http://www.cas.cn/syky/202212/t20221226_4858842.shtml
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

内质网定位的Hrd1协同细胞膜TLR4受体促进炎症反应的新功能和机制
肿瘤受体显像

【大师讲堂】David Julius教授:辣受体、热受体和痛觉受体究竟有什么区别?

《自然-通讯》发表刘剑峰团队发现GPCR多聚体“翩翩起舞”的规律
乳腺炎症

今日科技话题:“天狗咬日”、茶多酚可促进糖尿病伤口愈合、宇宙中锂丰度最高恒星、岛屿生活让鸟脑更大、高级别生物安全实验室投用

从“炎症”到“癌症”有多远?医生:这3种炎症不要拖
Trends Neurosci :衰老-炎症-AD
关注IBD患者精神心理健康,“益心关爱”项目圆满完成

Am J Gastroenterol:免疫抑制剂疗法与IBD患者肿瘤风险