科技工作者之家
科界APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-02-15
来源:中科院神经科学研究所
2020年1月23日,《eLife》期刊在线发表了中科院脑科学与智能技术卓越创新中心(神经科学研究所)、上海脑科学与类脑研究中心、神经科学国家重点实验室刘志勇研究组题为《耳蜗螺旋神经节在多个发育节点的深度转录组分析》的研究论文。
小鼠和人类的听觉系统在发育和功能上十分相似。耳蜗螺旋神经节负责把外周的声音信息(时间、强度和频率等)传递到脑干的耳蜗核,随后经脑干上橄榄核团、下丘、丘脑等最终到达听觉皮层。耳蜗螺旋神经节功能非常重要,临床上耳聋患者佩戴人工耳蜗的治疗效果很大程度上取决于耳蜗螺旋神经节是否具有功能。因此如何保持耳蜗螺旋神经节的功能以及如何在损伤后再生出有功能的螺旋神经节是听觉领域的一个重要且具有挑战的研究方向。
为了找到研究的切入点,研究团队首先致力于阐明两个问题:
1、耳蜗螺旋神经节在从胚胎早期到成年整个发育过程中,是否特异表达一些基因?
2、这些特异的基因是否具有动态的变化特征,是瞬时表达(调节发育过程),还是永久表达(维持神经节的细胞命运)?
为了准确回答这两个核心问题,研究团队利用转基因小鼠的方法,在五个不同的发育时期(E15.5, P1, P8, P14和P30), 特异在螺旋神经节内表达红色荧光蛋白。然后通过组织消化、手工分选的方法获得高纯度、健康的螺旋神经节细胞。每个时间点分析三个重复,每个重复样品包含100个左右螺旋神经节细胞。此方案能够获得高深度的全基因组表达谱,是之前10x单细胞转录组分析深度的5倍。基于此,本研究分析出了众多之前未知的螺旋神经节表达特异、动态变化明显的基因。
此外研究团队选取了两个特异基因Scrt2和Celf4,利用CRISPR/Cas9基因编辑系统构建了Scrt2-P2A-tdTomato和Celf4-3xHA-P2A-iCreER-T2A-EGFP两种基因敲入模型,并在内耳进行了系统的分析,在单细胞层面确认了耳蜗螺旋神经节特异并高表达Scrt2和Celf4,进而佐证了论文中转录组测序数据的准确性和可靠性。新构建的小鼠模型对听觉领域和脑神经科学领域(Scrt2和Celf4基因也在中枢系统高表达)的研究具有重要的应用价值。
该工作由中科院脑智卓越中心,听觉系统发育再生研究组刘志勇研究员指导,博士后李超、李响、毕政鸿为共同第一作者,王广琴,朱彤以及霍华德.休斯医学研究所-詹宁斯研究中心Ken Sugino为此研究做出了贡献。共聚焦成像相关工作在神经科学研究所所级中心的光学成像平台完成,神经科学研究所杨辉研究组提供了显微注射仪器,应文琴(杨辉组)在胚胎移植实验中提供了帮助。本工作得到国家重点研发计划、中国科学院战略性先导科技专项、国家青年千人计划、国家自然科学基金面上项目、上海市科技重大专项以及勃林格殷格翰公司专项支持。
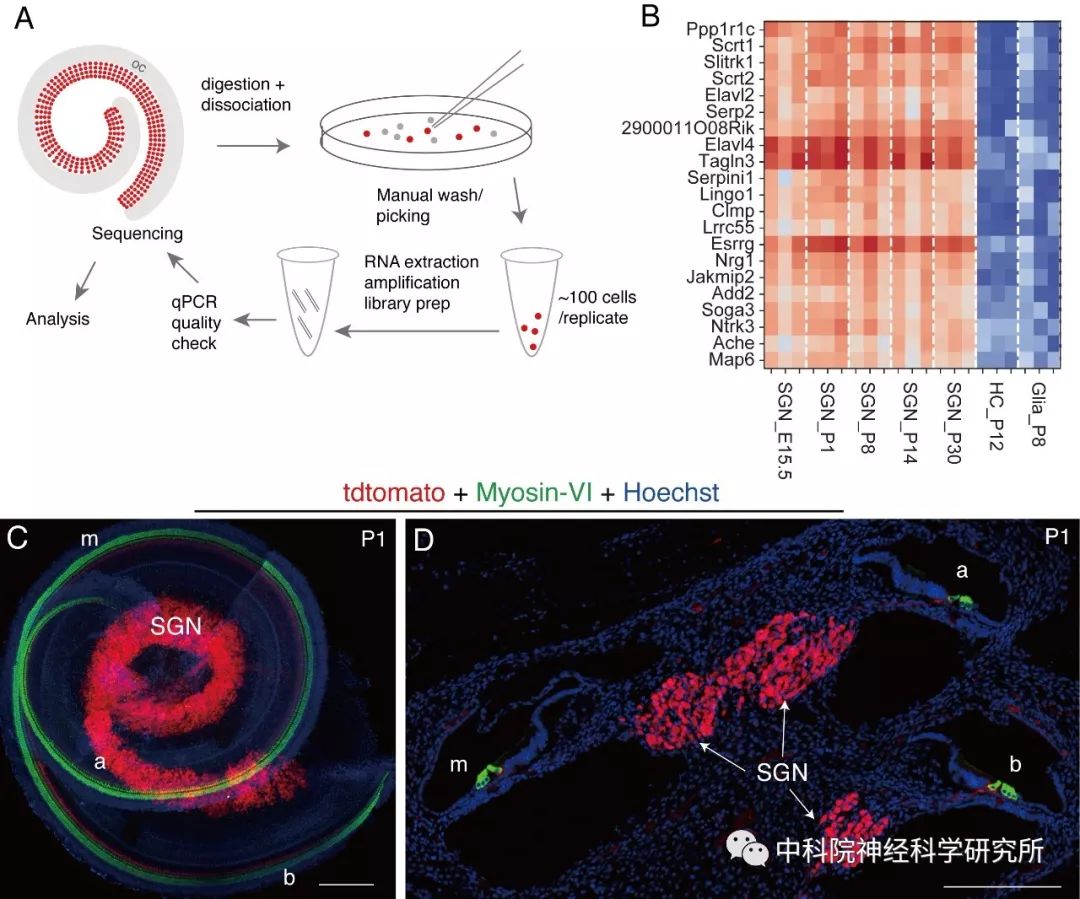
图注:(A) 图示为手工分选耳蜗螺旋神经节的流程,在荧光体视显微镜下,将红色荧光标记的螺旋神经节手工挑选并清洗三次后,转移至裂解液中进行后续实验;(B)热图显示小鼠耳蜗发育过程中,21个特异性、持续高表达在螺旋神经节细胞中的基因;(C-D)图为Scrt2-P2A-tdTomato小鼠(P1)耳蜗抗体Myosin VI(特异性标记毛细胞)和tdTomato 组织化学染色结果:组织铺片免疫组化染色(C)和切片免疫组化染色(D)显示Scrt2基因(tdTomato+)特异性高表达在耳蜗螺旋神经节中,毛细胞(Myosin VI+)中未见Scrt2基因表达, a:耳蜗顶圈;m:耳蜗中圈;b:耳蜗底圈;C图和D图中标尺为200 um
来源:ION-CAS 中科院神经科学研究所
原文链接:https://mp.weixin.qq.com/s?__biz=MzA5MzgxMDU3Mw==&mid=2670843567&idx=2&sn=37625628f3599ec085623ff4d8fc4c47&chksm=8a9d4c4dbdeac55b1d0b53a8cf07827c1d7ca4913e98a7054966c391768dc0580b7d5b6110dc#rd
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

基底神经节相关疾病治疗有了新线索
神经节细胞瘤

科技丨我国科学家成功实现视神经节细胞再生
颈上神经节
耳蜗螺旋神经节转录组分析研究获进展
我国科学家成功实现视神经节细胞再生
脊神经节

Nature:依赖于多巴胺和基底神经节的学习模型

我国科学家成功实现视神经节细胞再生

耳蜗螺旋神经节转录组分析研究获进展