科技工作者之家
科界APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-03-05
来源:iNature
血管紧张素转换酶2(ACE2)是SARS冠状病毒(SARS-CoV)和引起严重流行COVID-19的新冠状病毒(SARS-CoV-2)的细胞受体。但是具体的分子细节不是很清楚。2020年3月4日,西湖大学周强团队在Science在线发表题为“Structural basis for the recognition of the SARS-CoV-2 by full-length human ACE2”的研究论文,该研究利用冷冻电镜技术成功解析了此次新冠病毒的受体——ACE2的全长结构,这是世界上首次解析出ACE2的全长结构。另外,2020年3月1日,华盛顿大学David Veesler团队在Cell 在线发表题为“Structure, function and antigenicity of the SARS-CoV-2 spike glycoprotein”的研究论文,该研究显示SARS-CoV-2 S使用ACE2进入细胞,并且SARS-CoV-2 S与ACE2的结合能力明显高于SARS-CoV S与人ACE2的亲和力,这突出了SARS-CoV-2的该传染性。SARS-CoV-2 S糖蛋白在S1 / S2亚基之间的边界处具有furin蛋白酶切割位点,该位点在生物发生过程中被处理,并将这种病毒与SARS-CoV和SARS相关的CoV分开。

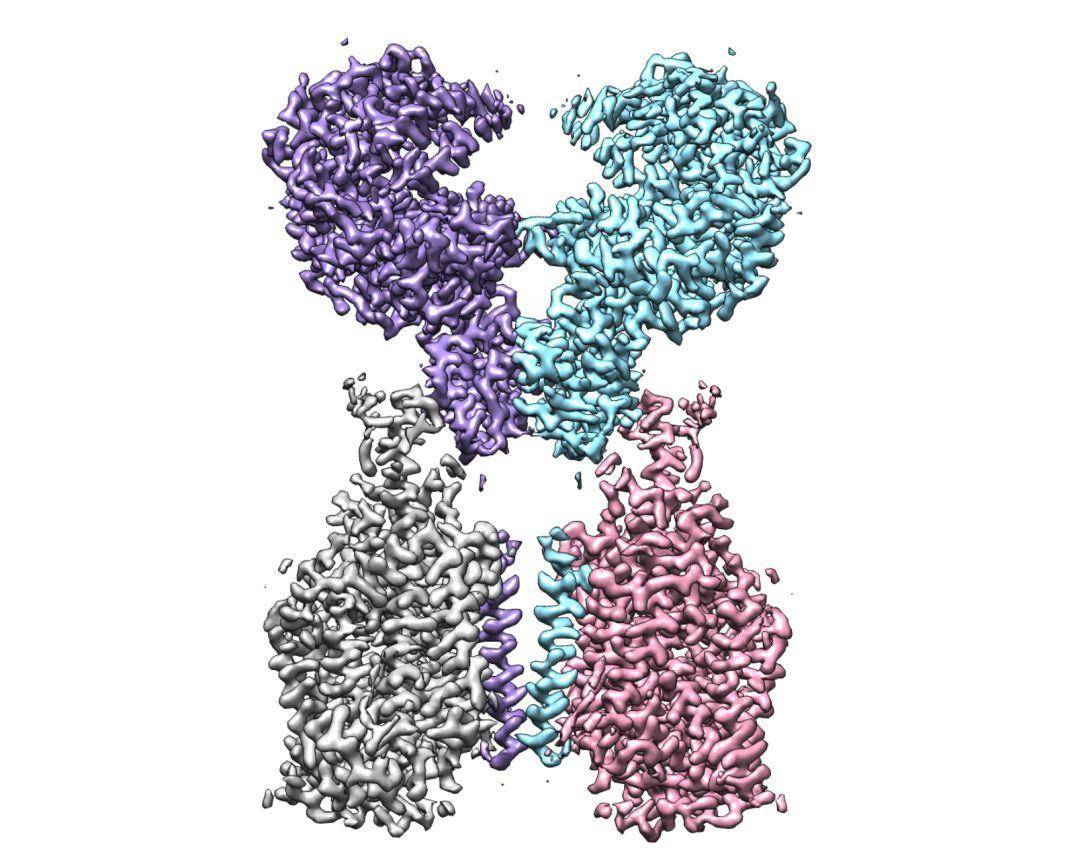
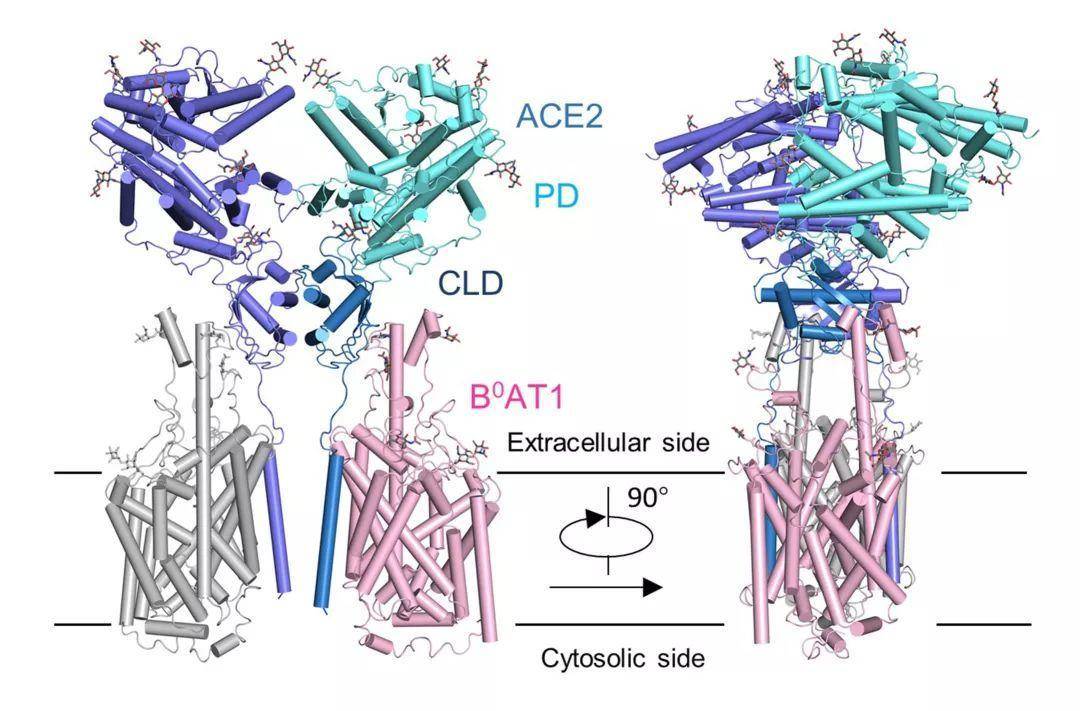
ACE2-B0AT1 复合物结构图
周强实验室针对这个问题进行了攻坚。第一步,他们要获取ACE2蛋白全长蛋白,但作为膜蛋白的ACE2本身很难在体外稳定获得。周强及博士后鄢仁鸿在文献中发现ACE2与肠道内的一个氨基酸转运蛋白B0AT1能够形成复合物。根据他们过去的研究经验,这个复合物极有可能稳定住ACE2。果然,他们通过共表达的方法获得了ACE2与B0AT1优质稳定的复合物,并利用西湖大学的冷冻电镜平台成功解析了其三维结构,分辨率达到2.9埃,对于病毒识别至关重要的胞外结构域分辨率为2.7埃。(注:3埃是评价蛋白质结构分辨率的分界点。3埃以内的可以认为是高分辨率结构,在电子密度图上可以很清楚的确定侧链构象,侧链之间的盐键,氢键等相互作用。)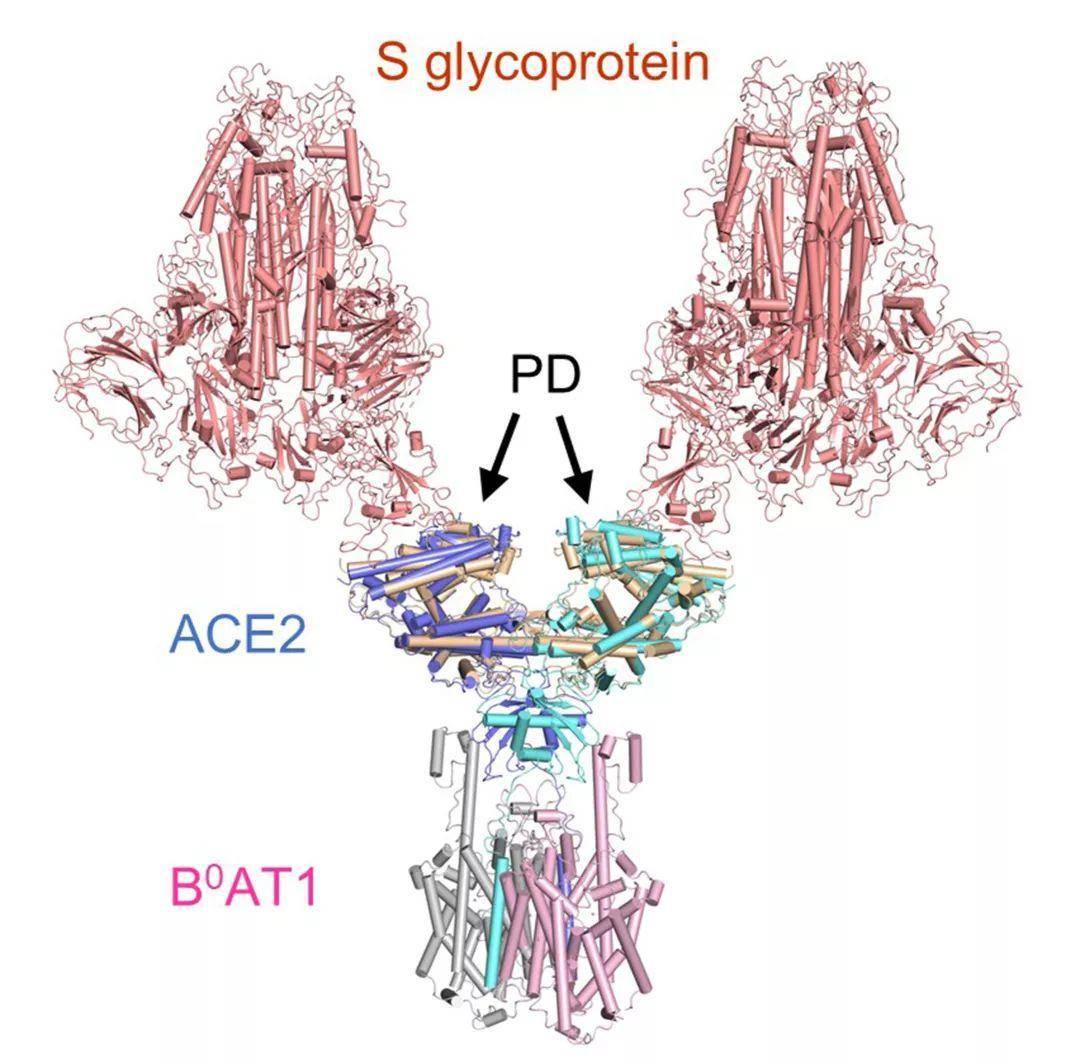 ACE2-B0AT1 复合物和之前解析复合物(SARS-CoV的S蛋白与ACE2的PD结构域的复合物)的比较,两种复合物通过PD结构域锚定在一起。通过分析ACE2的全长蛋白结构,周强实验室发现ACE2以二聚体形式存在,同时具有开放和关闭两种构象变化,但两种构象均含有与冠状病毒的相互识别界面。这一研究发现为进一步解析全长ACE2和新冠病毒的S蛋白复合物的三维结构奠定了基础。而这个工作本身为理解新冠病毒侵染细胞提供了很多有趣的线索。比如,ACE2的二聚体与新冠病毒S蛋白的三聚体是否可以发生更高层级的交联,从而促进病毒与宿主细胞膜的融合或者内吞?之前有研究表明ACE2的胞外区如果被切割,将会更有效地促进冠状病毒的侵染,但是ACE2与B0AT1的复合物结构显示B0AT1的存在有可能阻碍蛋白酶靠近这个切割位点,这是否解释了病毒侵染症状主要发生在没有B0AT1的肺部?“总之,ACE2全长结构的解析,将有助于理解冠状病毒进入靶细胞的结构基础和功能特征,对发现和优化阻断进入细胞的抑制剂有重要作用”,清华大学全球健康与传染病研究中心主任张林琦教授说。
ACE2-B0AT1 复合物和之前解析复合物(SARS-CoV的S蛋白与ACE2的PD结构域的复合物)的比较,两种复合物通过PD结构域锚定在一起。通过分析ACE2的全长蛋白结构,周强实验室发现ACE2以二聚体形式存在,同时具有开放和关闭两种构象变化,但两种构象均含有与冠状病毒的相互识别界面。这一研究发现为进一步解析全长ACE2和新冠病毒的S蛋白复合物的三维结构奠定了基础。而这个工作本身为理解新冠病毒侵染细胞提供了很多有趣的线索。比如,ACE2的二聚体与新冠病毒S蛋白的三聚体是否可以发生更高层级的交联,从而促进病毒与宿主细胞膜的融合或者内吞?之前有研究表明ACE2的胞外区如果被切割,将会更有效地促进冠状病毒的侵染,但是ACE2与B0AT1的复合物结构显示B0AT1的存在有可能阻碍蛋白酶靠近这个切割位点,这是否解释了病毒侵染症状主要发生在没有B0AT1的肺部?“总之,ACE2全长结构的解析,将有助于理解冠状病毒进入靶细胞的结构基础和功能特征,对发现和优化阻断进入细胞的抑制剂有重要作用”,清华大学全球健康与传染病研究中心主任张林琦教授说。
周强(右)和鄢仁鸿(左)
周强博士,1982年出生,黑龙江人。2000-2004年本科就读于清华大学,获学士学位。2004-2012年博士师从隋森芳院士,获博士学位。2015年博士后出站后在清华大学医学院颜宁教授课题组任副研究员。2019年初加盟西湖大学担任西湖学者、特聘研究员,开展独立研究工作。来源:Plant_ihuman iNature
原文链接:https://mp.weixin.qq.com/s?__biz=MzU3MTE3MjUyOA==&mid=2247507516&idx=2&sn=6447a166b44dc09ba03edfa6e84710b5&chksm=fce6ade3cb9124f5c8b455e90c39e6f9a182630aaaed206ee94d4f9c542b8fd9ad34051d818a#rd
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
宇宙可能到处都是外星病毒,或成发现外星人首个迹象
重组人ACE2蛋白可削弱新型冠状病毒的感染能力,幅度超千倍

ACE2以外的新冠病毒潜在受体发布

【权威观点】专家:新型冠状病毒不是SARS冠状病毒

评论:“坏兔子”病毒闹心,怎样才能将网络恶棍拦在门外

我国首个P4实验室正式运行,致力于最危险病毒研究

【权威观点】专家:新型冠状病毒不是SARS冠状病毒
武汉冠状病毒nCov-2019再利用治疗法:基于超级计算机分析的病毒刺突蛋白与人类ACE2受体的结合
《自然》发文:麻省理工学院发现海洋中一种未知病毒

人源化ACE2小鼠助力抗病毒药物试验、疫苗开发