科技工作者之家
科界APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-03-05
来源:药学进展
专家介绍:何前军

博士、教授、博士生导师、欧盟玛丽·居里学者、深圳市海外高层次人才、深圳大学领军学者、深圳大学医学部“先进纳米药物实验室”负责人。长期从事纳米生物医用材料方面的研究,开辟了“纳米气体医学”研究领域,国际上首次提出了“氢热疗法”。在Nature Communications、Advanced Materials、Angewandte Chemie、Biomaterials、Chemical Society Reviews等国际顶级期刊发表SCI论文100多篇,引用8000多次,h指数48。2018年入选“全球高被引科学家”。近年来主持了十余项国际级、国家级和省市级科研项目。荣获欧盟玛丽·居里国际引进人才奖(2012)、中科院“卢嘉锡”青年人才奖(2012)、中国新锐科技人物奖(2018)、中科院“院长”特别奖(2011)、中科院“百篇优博”(2011)、深圳市海外高层次人才奖(2015)等奖励。
正文
氢气的生物学效应及可控靶向递送
[摘要]氢气是一种有前途的气体治疗分子,具有较高的生物安全性,对多种疾病具有明显的治疗效果,但其作用机制尚不非常明确。氢气的非靶向蓄积性和易扩散特性使得常规的口服和沐浴等方式难以实现氢气在病变部位的靶向高浓度蓄积,导致其治疗效果受限。纳米供氢材料为实现氢气的靶向可控递送提供了解决途径。基于以上问题,简介实现靶向可控释放氢气的纳米材料,通过对氢气治疗不同疾病可能的作用机制进行综述,对氢气治疗当前面临问题和解决方案提出建议,旨在为氢气治疗的机制和应用研究提供参考。
气体治疗是一种新兴的治疗方法,主要是利用气体分子(NO、CO、H2S和H2等)治疗疾病。其中H2相对于其他气体具有更高的生物安全性,受到越来越多的关注。1975年,高压H2被发现可被用来改善皮肤癌。2007年,H2被证明可选择性地清除有害的自由基从而降低炎症和缺血再灌注对机体的损伤。随后一系列应用基础研究表明:H2对包括癌症、糖尿病、卒中、动脉粥样硬化、帕金森病、阿尔茨海默病(AD)、关节炎、皮炎、结肠炎、肝炎、胰腺炎、心肌梗死等疾病均有明显的治疗效果。H2的治疗效果与浓度密切相关,目前H2用于疾病治疗主要通过呼吸H2和饮用富氢水,然而这2种方式均不能向病灶组织靶向递送H2。为提高疾病部位的H2浓度实现更好的治疗效果,可以通过纳米载体向病灶组织靶向递送高浓度的H2,从而更加有效地治疗疾病。H2治疗的主要机制通常被认为起因于选择性抗氧化作用,但是H2对不同疾病的具体治疗机制可能不同,也可能存在其他作用机制。本文针对不同疾病,讨论了H2的治疗效应及其可能的作用机制,并总结了H2靶向递送策略。
1氢气治疗的机制
1.1选择性抗氧化
氧化应激是活性氧(ROS)和活性氮的释放和积累的结果,是许多人类疾病的共同特征。大量研究表明,这种氧化还原稳态的失衡与疾病的发生和发展均有重要关联。氧化应激可直接或间接损伤DNA、蛋白质和脂质等,引起包括缺血再灌注损伤、神经退行性疾病、衰老、心血管疾病、糖尿病、关节炎和肿瘤等疾病的发生和发展。目前,常使用抗氧化剂来治疗氧化应激导致的疾病,但常规的抗氧化剂在清除有害ROS的同时,也会无选择性地清除一些具有生理作用的有益ROS,因此需要严格控制剂量从而避免过量使用引发的毒性。然而H2选择性抗氧化的效果可以克服这个缺陷。2007年,Ohsawa等报道,H2可以选择性地清除一些有毒性的ROS(如羟自由基·OH和过氧亚硝酸根阴离子ONOO-)而不影响具有生理效应的ROS(包括H2O2和NO·),随后证明H2是一种对其他缺血再灌注损伤同样有效的选择性抗氧化剂。最近的研究表明,在许多人类疾病和啮齿动物模型中,H2可激活内源性抗氧化酶如超氧化物歧化酶(SOD)和过氧化氢酶(CAT),并呈剂量依赖性地降低各种氧化应激标记物[如髓过氧化物酶(MPO)、丙二醛(MDA)、8-异前列腺素和硫代巴比妥酸]的浓度。此外,H2还通过调控自由基依赖性氧化磷脂的产生来调节某些基因的转录,通过Ca2+信号转导途径来减轻氧化应激损伤。
1.2抗炎
炎症是机体对损伤的反应,包括全身反应和局部反应,是机体为了消除有害刺激以及启动组织愈合过程而进行的一系列复杂生理反应。慢性炎症是许多疾病状态的重要组成部分,包括肿瘤、肥胖、2型糖尿病、动脉粥样硬化、哮喘、银屑病和神经退行性疾病。一系列研究表明:H2可抑制氧化应激引起的炎症组织损伤。Nakao等研究表明,通过呼吸含有2%H2的空气可以减轻肠移植术后损伤并改善其术后功能,且证明了H2主要通过调节白细胞介素(IL)-1β、IL-6、趋化因子2(chemokineligand2,CCL2)的mRNA水平起作用。最近Ji等构建了全脑缺血再灌注大鼠模型,通过腹腔注射富氢水证明H2能显著降低缺血再灌注诱导的MDA、caspase、肿瘤坏死因子α(TNF-α)、IL-6、核因子-κB(NF-κB)的水平,同时减轻海马组织损伤。Li等通过腹腔注射富氢水治疗缺血再灌注损伤,证明富氢水可以增加损伤侧脑组织内源性抗氧化酶(SOD和CAT)的活性,降低损伤侧脑组织中氧化产物(8-异前列腺素F2α和MDA)和炎性细胞因子[TNF-α和高迁移率族蛋白B1(HMGB1)]的水平,减少氧化应激和炎症介导的缺血再灌注损伤。Zhang等研究发现,富氢盐水处理可减轻缺血再灌注诱导的心肌细胞凋亡,降低局部心肌缺血再灌注大鼠心肌危险区中性粒细胞浸润、3-硝基酪氨酸水平、细胞间黏附分子-1(ICAM-1)表达和MPO活性,降低促炎细胞因子、TNF-α和IL-1β的水平,证明了富氢盐水对大鼠局部心肌缺血再灌注具有抗炎作用。Liu等研究表明,miR-9、miR-199和miR-21在氢分子对脂多糖(LPS)激活的小胶质细胞的抗炎调节中起重要作用。此外,氢分子还可以下调炎症介质(如巨噬细胞趋化蛋白1和ICAM-1)和促炎转录因子(如HMGB1、NF-κB和前列腺素E2)。H2通过恢复丢失的调节性T细胞来保护小鼠免受慢性胰腺炎的侵袭。此外,H2可通过Toll样受体4(TLR4)介导的信号调节发挥抗炎作用。
1.3抗凋亡
凋亡是细胞死亡的一种生理过程,对于多细胞生物的正常发育和功能至关重要。细胞死亡控制异常可能导致多种疾病,包括肿瘤、自身免疫性疾病和退行性疾病。细胞凋亡的信号可通过多种独立的途径发生。细胞凋亡通路包括胞外及胞内启动的细胞凋亡。胞外启动的细胞凋亡为通过受体介导的死亡信号通路,其主要由外源信号引起,如Fas/Fasl、TNF-α/相应受体等,这些受体的连接导致细胞内凋亡级联反应相继激活,包括caspase。胞内介导的细胞凋亡主要由线粒体介导,线粒体内细胞色素C释放激活caspase-9,引起caspase级联反应。细胞凋亡是许多疾病共同的病理基础,在疾病的发生发展中起重要作用。有研究表明,吸入H2可抑制脑缺血-缺氧所致新生鼠神经元的凋亡,减少海马和皮层神经元的凋亡数、caspase-3和caspase-12活性[8,22]。H2对新生鼠脑缺血-缺氧损伤的保护与抑制神经细胞凋亡密切相关。
1.4激活细胞信号通路
H2也可能通过调节相关的细胞信号通路实现疾病的治疗。Wang等通过连续腹腔注射饱和富氢生理盐水,治疗由静脉注射Aβ1-42所致的AD大鼠,发现分子氢可显著降低大鼠脑组织c-Jun氨基末端激酶(C-JunN-terminalkinase,JNK)和NF-κB的水平;认为含饱和H2的富氢生理盐水减轻大鼠Aβ1-42诱发的神经炎症和氧化应激,是通过抑制JNK和NF-κB活性实现的。此外,Liu等研究证明H2降低肝组织中TNF-α和IL-6的水平,通过抑制磷酸化降低细胞外调节蛋白激酶(ERK1/2)的活性,从而缓解炎症反应。Itoh等通过体外H2培养箱培养RBL-2H3肥大细胞4h后,加入IgE培养24h,发现H2抑制IgE高亲合力受体FcεRI相连的Lyn和其下游分子脾酪氨酸激酶(Syk)、磷脂酶C-γ1(PLCγ1)、PLCγ2、蛋白激酶B(Akt)、ERK1/2、JNK、P38、胞浆型磷脂酶A2(cPLA2)的磷酸化,从而减少肥大细胞脱颗粒,并指出在速发型超敏反应中,H2的保护作用不是通过清除自由基实现,而是通过调节信号通路实现,推测H2可能和NO一样是一种气体信号分子。
2氢气用于疾病治疗
2.1氢气用于肿瘤治疗
恶性肿瘤是目前人类三大死因之一。基于H2的安全性和有效性,H2的抗肿瘤研究受到较大的关注。早在1975年,Dole等证明高压H2可以抑制皮肤癌的进程。近年来大量临床研究表明,通过饮用富氢水可以抑制体内氧化应激水平并通过提高血清的抗氧化能力,降低化疗及放疗的副作用。此外,H2通过选择性清除活性氧可减缓辐射诱导的胸腺淋巴瘤的生长,可以抑制癌细胞增殖。吸入H2可以显著提升肿瘤患者的免疫力,降低放化疗的副作用,改善患者生活质量。此外,笔者所在课题组首次提出氢热治疗的概念,借助氢化钯纳米颗粒的光热效应,将H2治疗与热疗有效联合,显著提高了热疗的抗肿瘤效果,并降低了热疗的副作用(见图1)。同时,提出H2抗肿瘤的机制可能是其选择性抗氧化作用,通过打破肿瘤内氧化还原平衡,产生氧化还原应激,导致肿瘤细胞损伤和凋亡,这种协同治疗的策略同时被证明还可改善光热对于正常细胞的副作用,另外H2还可通过腺苷酸激活蛋白激酶(AMPK)途径促进肿瘤细胞凋亡。为了获得更高的载氢量,笔者所在课题组进一步利用更高负载比例的单原子钯配位金属有机框架(PdH-MOF)作为载体,实现了良好的抗小鼠乳腺癌效果。另外,通过酸响应释氢的硼化镁纳米片制备的口服药物,证明了H2可以有效地提高化疗药物对胃癌的治疗效果,同时减低化疗药物对机体的副作用。
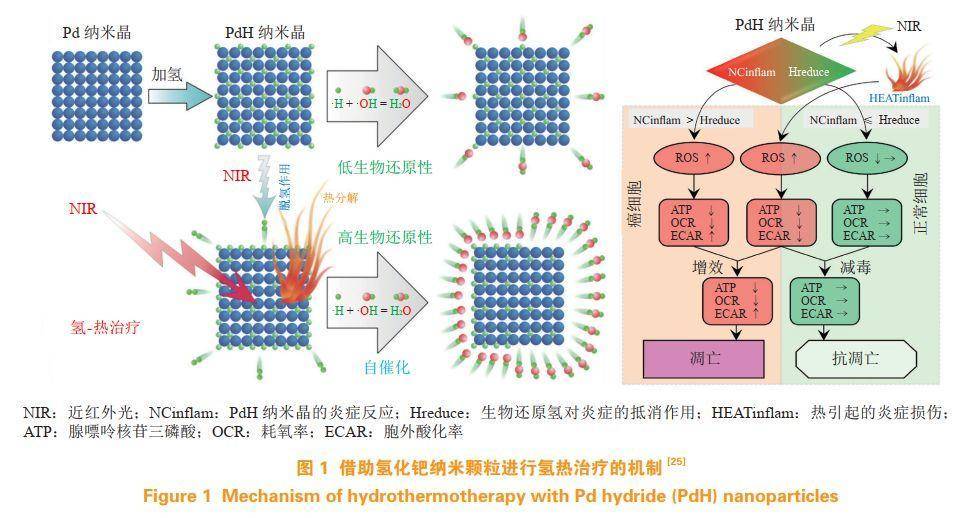
2.2氢气用于神经退行性疾病的治疗
神经退行性疾病是神经元和(或)其髓鞘的丧失所致,并随着时间的推移而恶化,出现功能障碍。过去的研究表明:过度的氧化应激和异常的泛素-蛋白酶体系统诱导的多巴胺能神经细胞死亡是诱发帕金森病的主要起因。由于神经递质多巴胺是一种促氧化剂,因此多巴胺能神经细胞要暴露于高浓度的ROS中,过度的氧化应激是导致多巴胺能神经元细胞死亡的原因之一。Fu等利用6-羟基多巴胺建立初步显示帕金森病的大鼠模型,手术前1周与手术后3d喂养富氢水,治疗与未经治疗的小鼠对比,无论是术前还是术后进行富氢水喂养,H2对6-羟基多巴胺注射诱导的帕金森病均具有抑制作用,同时提出富氢水的喂养对大鼠的多巴胺能神经细胞具有延迟保护作用,抑制帕金森病的发展。Fujita等同样证明了富氢水在1-甲基-4-苯基-1,2,3,6-四氢吡啶诱导的帕金森病小鼠模型中具有类似的显著效果。
AD主要的特征是Aβ和Tau蛋白的异常聚集,其形成的大聚集体主要包括老年斑和神经原纤维缠结。Nagata等通过限制运动建立AD小鼠模型,通过被动回避学习、物体识别任务和Morris水迷宫实验分析了小鼠的认知功能,证明了富氢水有效地改善了AD小鼠的认知障碍,同时表明H2可以恢复齿状回中的神经增殖。Li等通过脑室注射Aβ1-42建立了AD大鼠模型,通过Morris水迷宫实验和长时程增强(LTP)的电生理测量分析了大鼠的认知功能,发现腹腔注射富氢盐水可以有效改善AD大鼠的认知减退并保留了LTP,随后证明这种保护作用是通过抑制IL-1β、JNK和NF-κB的异常激活来介导的。最近笔者所在课题组使用随机性别的携带人基因突变体APPswe、PS1M146V和tauP301L的小鼠模型(3×TG-AD),通过对小鼠发病脑区立体注射高效载氢的氢化钯纳米颗粒进行原位治疗,随后利用细胞实验、Morris水迷宫实验、免疫印迹及Nissl染色实验,证明了高活性氢通过消除氧化应激和激活抗氧化途径,恢复线粒体功能障碍,抑制Aβ的产生和聚集,阻断突触和神经元凋亡,促进神经元能量代谢,从而改善AD小鼠的认知障碍(见图2)。
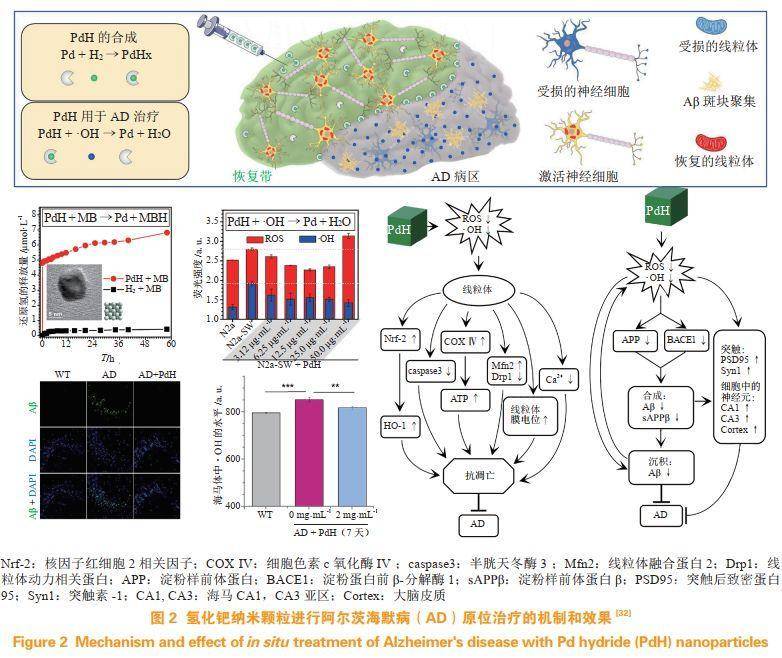
2.3氢气用于器官缺血再灌注损伤的治疗
缺血再灌注损伤不仅涉及细胞内损伤过程,还涉及到损伤性炎症反应。炎症反应的细胞内损伤过程和损伤性炎症相互关联。缺血期以缺氧细胞损伤为主。由于线粒体ATP生成的减少打破了细胞离子稳态,水解酶的激活和细胞膜的选择性、通透性丧失。一旦血液重新供应,炎症反应立即开始。此时受影响组织的细胞、血源性细胞和非细胞成分(如补体系统)被激活。在再灌注阶段发生的细胞损伤可能是在缺血阶段已经开始细胞改变的结果,也可能是炎症反应的结果。细胞内损伤性改变部分与缺氧细胞损伤有关。此外,细胞内信号级联和凋亡途径的激活也可能发生。除了细胞损伤的比率大幅下降外,在热缺血和冷缺血期间的损伤过程之间不存在显著差异,因为细胞的损伤在缺血期间已经变得明显。相反,在再灌注阶段,炎症反应和细胞损伤的损伤过程明显不同,取决于预先存在的热缺血和冷缺血。由于缺血再灌注损伤发病机制的复杂性,需要一种有效的方法来提供对缺血再灌注损伤的保护。Ohsawa等报道了H2通过选择性清除高毒性活性氧的机制保护缺血再灌注损伤,该研究首次证明了H2可以降低缺血再灌注导致的氧化应激反应对脑部的伤害。孙学军课题组研究发现,通过呼吸含2%H2的空气可有效地治疗新生大鼠的脑缺血性损伤;进一步的研究发现,H2可以通过下调由于缺血再灌注诱导的MDA、caspase、TNF-α、IL-6和NF-κB,减轻海马组织的损伤。随后Ohsawa课题组研究发现,H2对非脑组织的其他位置缺血再灌注损伤的治疗同样有效。
3氢气的可控靶向递送策略
H2的治疗效果与疾病部位的气体浓度是紧密相关的,目前利用H2给药主要通过吸入H2、饮用含氢水、注射和滴加含氢生理盐水及氢水沐浴等方式,然而这些全身性的给氢方式缺乏靶向性,难以实现持续局部较高浓度H2给药,一定程度上限制了H2的治疗效果。由于H2是一种生理安全性极高的气体,即使高浓度的H2也不会对正常细胞产生明显的副作用,而理论上H2的治疗效果与其浓度正相关,因此如何实现H2在治疗部位的局部有效浓度是H2治疗的重点之一。响应性纳米药物为实现疾病组织的靶向高效给氢从而提高H2的治疗效果提供了重要的平台。根据刺激源的类型提出响应性纳米药物的设计策略,并从外刺激(包括光、超声波、磁场等)和内刺激2个方面进行介绍。
3.1外源性刺激响应纳米药物的设计策略
外源性刺激实现药物的响应释放具有良好的时空可控性,可利用的刺激源包括光、超声波、磁场等。笔者所在课题组利用钯纳米颗粒作为载体,通过H2鼓泡法载氢;载氢后的氢化钯在近红外光照射下响应性释放H2,实现了光声成像引导下的肿瘤氢热联合治疗,具有比单纯光热治疗更好的抗肿瘤效果(见图3A)。同时,进一步合成了Pd-MOF,由于单原子的钯均匀地分散在MOF骨架中,使得H2更加容易地被钯原子吸附,实现了更高的H2负载和更加灵敏的近红外光响应释放性,具有更好的肿瘤治疗效果。光催化水解产氢也被用于实现持续可控的H2释放。Wan等通过合成了由叶绿素a(Chla)、L-抗坏血酸(AA)和包裹在脂质体(LIP)系统中的金纳米颗粒(AuNPs)组成的纳米反应器,通过模拟光合作用产生高水平的H2,并将其局部浓度提高到治疗水平(见图3B)。此外,LIP近红外系统在体外和体内均可降低氧化应激,并减少促炎细胞因子如IL-6和IL-1β的过量产生。Zhang等通过以半导体聚合物量子点(Pdots)作为催化剂共价负载LIP,构建了包含反应物、中间体和副产物的光驱动纳米器。在激光照射下原位连续产生H2,然后穿透LPS并有效地降低LPS诱导的体外炎症和体内炎症。He等利用微泡负载H2,实现了非侵入性的超声响应释氢与超声成像的诊疗一体化,有效地防止了心肌缺血再灌注损伤。
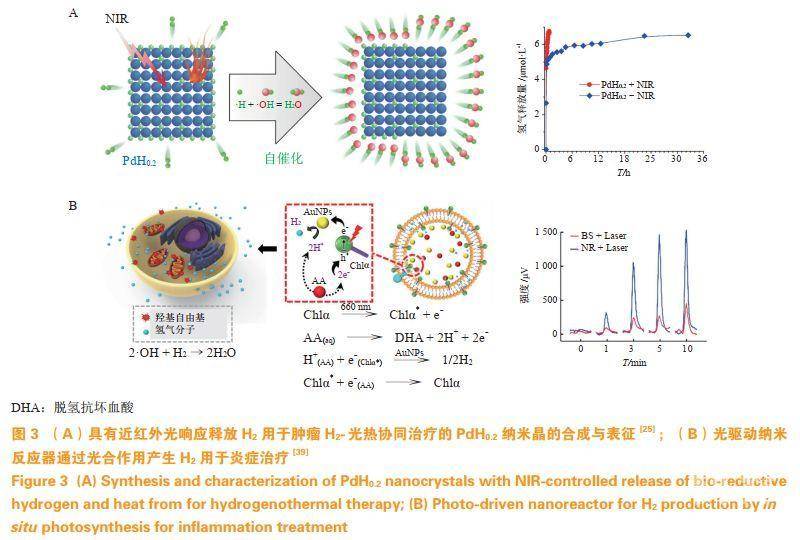
3.2内源性刺激响应纳米药物设计策略
内源性刺激纳米药物利用患病组织与正常部位化学环境的差异性(如pH、ROS浓度、谷胱甘肽浓度等),实现药物在疾病组织的靶向蓄积及可控释放。笔者所在课题组利用介孔二氧化硅高效负载H2的前体药物氨硼烷(AB@MSN),通过AB@MSN响应肿瘤微酸性环境分解产生H2,HeLa肿瘤小鼠模型证明AB@MSN能有效地杀死肿瘤细胞并抑制肿瘤的增殖(见图4A)。笔者所在课题组进一步通过水热合成纤维素包裹的单质铁纳米颗粒(Fe@CMC),利用单质铁在肿瘤的酸性环境中反应产生H2,同样实现了很好的抗肿瘤效果(见图4B)。此外,笔者所在课题组通过利用超声辅助化学剥离的方法获得二维硼化镁纳米片(MBN@PVP),可以在胃酸中反应产氢,用于胃癌的原位治疗(见图4C)。Zhang等利用聚多巴胺和氨硼烷的生物膜伪装纳米药物(mPDAB),以增强光热治疗的疗效和减轻炎症,mPDAB在完全消除原发肿瘤的同时,也抑制了远处休眠肿瘤的生长(见图5A)。Kong等构建了具有核-壳结构的Mg@SiO2纳米粒(Mg@p-SiO2MPS),通过调节外壳介孔二氧化硅的厚度调控Mg与水的反应速率控制产生H2的速度(见图5B)。Wan等通过聚乳酸-羟基乙酸包裹的镁粉(Mg@PLGAMPS)有效地减轻组织炎症,防止软骨破坏,阻止骨关节炎(OA)的发展(见图5C)。
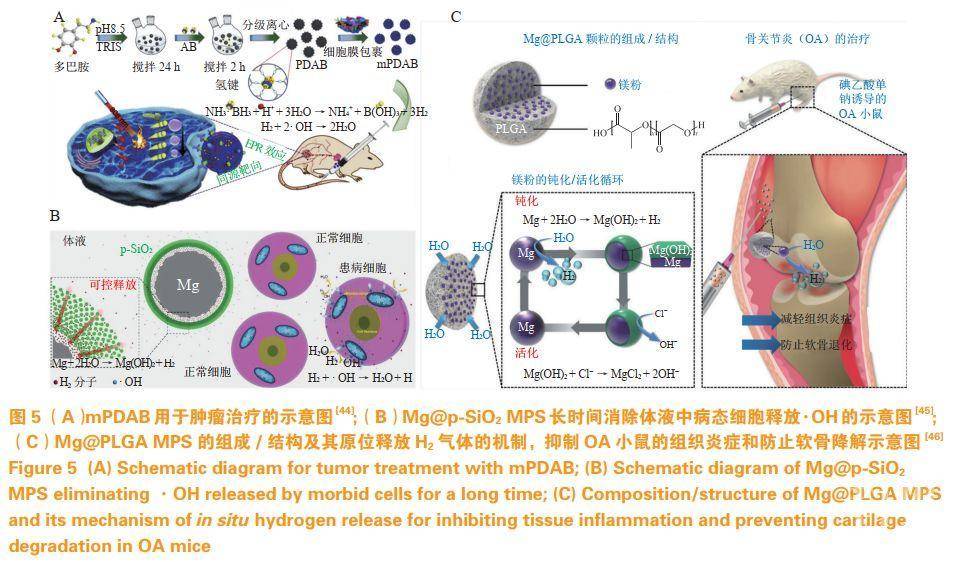
4结语
目前大量临床研究表明:H2对多种疾病均有治疗效果,且至今尚未发现显著的副作用。H2治疗的主要机制目前被广泛接受的是H2具有选择性抗氧化的作用,其相对于其他抗氧化剂如维生素类抗氧化剂等的优势主要在于H2选择性地清除导致氧化损伤的高毒性羟自由基和过氧亚硝酸阴离子,同时对具有生理作用的活性氧不影响;但也可能存在其他更深层次的机制。H2治疗待解决的问题主要包括其作用靶点及作用方式尚未明确,其在体内的代谢途径尚未明确,还没有大量长期大剂量的研究证实H2的绝对安全性,H2治疗疾病的机制有待进一步研究。目前H2治疗的给氢方式普遍效率低下,难以达到有效的治疗浓度,如何实现高浓度及良好生物安全性的给氢方式有待进一步研究,尤其是如何设计高效载氢并高度靶向疾病组织实现H2有效治疗,且低毒的纳米载体是有待解决的问题之一。
来源:ppsyxjz 药学进展
原文链接:https://mp.weixin.qq.com/s?__biz=MzA5MDY3ODExNQ==&mid=2651308402&idx=1&sn=1103d162d8a4f2e3885d7b2bbc894054&chksm=8bf4977ebc831e6810c3bcbe9a52c6d4262806f58a9d8bbc1ca5081be935886b9752573ae5e9#rd
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
健康 纳米 养生 氧化应激 纳米效应 缺血再灌注损伤 富氢水
研究发现G6PD抗氧化应激不依赖氧化磷酸戊糖途径
富氢水:“氢”情传递 健康长久



DNA硫代磷酸酯的氧化应激新机制
王淼团队揭示心肌缺血再灌注损伤机制与治疗意义
肝缺血再灌注损伤靶点找到
Nature:急性无菌免疫反应促进心脏缺血再灌注损伤细胞治疗效果

以基础研究解决临床问题,武汉大学李红良团队发现心脏缺血再灌注损伤的潜在治疗靶点
实锤!氧化应激加速细胞衰老

郑州大学张水军/郭文治发现肝缺血再灌注损伤的潜在治疗靶点
研究发现肝脏缺血再灌注损伤原因