科技工作者之家
科界APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-03-10
来源:BioArt
原标题:Nat Comm:Ray Stevens/宋高洁合作揭示全长GLP-1R的配体结合前构象
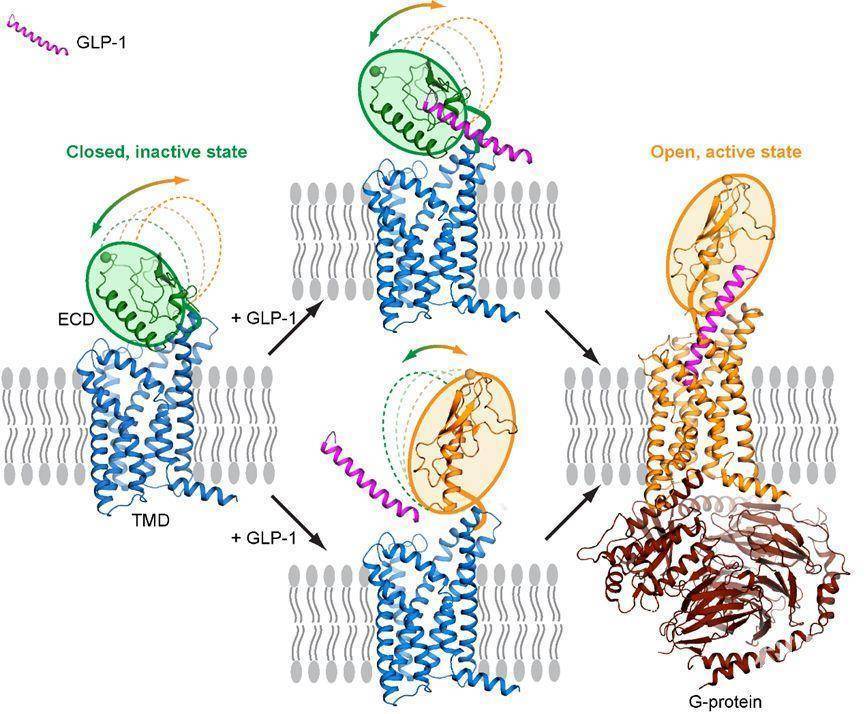 图1. 全长GLP-1R的活化过程模型(左侧为本项研究测定的闭合态结构)
图1. 全长GLP-1R的活化过程模型(左侧为本项研究测定的闭合态结构)原文链接:
https://www.nature.com/articles/s41467-020-14934-5
参考文献
1.Graaf, C. et al. Glucagon-Like Peptide-1 and ItsClass B G Protein-Coupled Receptors: A Long March to Therapeutic Successes. Pharmacological reviews 68, 954-1013, doi:10.1124/pr.115.011395(2016).
2.Song, G. J. et al. Human GLP-1 receptortransmembrane domain structure in complex with allosteric modulators. Nature 546, 312-+, doi:10.1038/nature22378 (2017).
3.Zhang, Y. et al. Cryo-EM structure of theactivated GLP-1 receptor in complex with a G protein. Nature 546, 248-+,doi:10.1038/nature22394 (2017).
4. Jazayeri, A. et al. Crystal structure of the GLP-1receptor bound to a peptide agonist (vol 546, pg 254, 2017). Nature 548, doi:10.1038/nature23311 (2017).
5. Liang, Y. L. et al. Phase-plate cryo-EM structure ofa biased agonist-bound human GLP-1 receptor-Gs complex. Nature 555, 121-+,doi:10.1038/nature25773 (2018).
6. Zhang, H. N. et al. Structure of the full-lengthglucagon class B G-protein-coupled receptor. Nature 546, 259-+,doi:10.1038/nature22363 (2017).
来源:BioGossip BioArt
原文链接:https://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652481923&idx=7&sn=099fa359e9b42f21a893cc507c807c5e&chksm=84e23a37b395b321f18185363a0b89f0684b150b872f39591c6df80894172425356e874aec2c#rd
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
生长激素释放激素受体结构及功能研究取得进展

人体细胞内存在“铁路”系统,能自动优化结构

『主编手记』 不懈的动力
【复材资讯】科学家首次实现陶瓷4D打印

【前沿】MIT新开发的 AI 模型有望改进恶性脑瘤治疗
汪胜/程建军团队报道基于结构的多巴胺D2受体选择性配体

研究揭示GPCR胆汁酸受体配体识别和激活的独特机制

为何卢浮宫博物馆地下有台粒子加速器?
抗体结构的启发:将任意核酸适配体转化为结构开关型核酸适配体
Nat Comm :汪胜/程建军合作揭示结构指导设计的多巴胺D2受体选择性配体