科技工作者之家
科界APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-03-25
来源:BioArt
撰文 | 赤贞
人体皮肤由分层的鳞状上皮构成,其最表层是无核、扁平的皮肤鳞片,用以抵抗外界的极端环境。皮肤鳞状上皮具有较强的自我更新能力,其基底层祖细胞在向上迁移的过程中逐步分化、丢失胞核并最终形成死细胞层。在形态学上,这一过程伴随着不分裂角质形成细胞胞浆内角质透明蛋白颗粒(KG)的形成、解聚和消失。
2020年3月13日,洛克菲勒大学Elaine Fuchs团队在Science上发表长文Liquid-liquid phase separation drives skin barrier formation,证实角质透明蛋白颗粒的形成是由丝聚蛋白“液-液相分离”驱动的,该相分离的动力学调控着角质细胞的终末分化,并承担着感知外界环境变化的任务。

Elaine Fuchs院士团队在2015年曾通过蛋白组学技术手段,发现角质透明蛋白颗粒(KG)的主要成分之一——丝聚蛋白(filaggrin, FLG)含有内源性无序区,具备发生相分离的能力,而其截短突变体则是导致皮肤屏障障碍类疾病最常见的病因之一。因此,在本研究中,研究者通过荧光传感器,对丝聚蛋白及其突变体在小鼠体内及体外条件下发生相分离的能力和动态变化进行了探究。
首先,作者发现,丝聚蛋白及其旁系同源蛋白拥有更多的精氨酸(arginine bias=R/(R+K)),这使得他们拥有更多的与芳香族氨基酸互作的位点;其次,该家族蛋白中比例最高的芳香族氨基酸是组氨酸——既往研究显示,富含组氨酸的内在无序蛋白必须很大才能显现出相分离行为,而丝聚蛋白家族是人类蛋白质组中最大的蛋白之一(435kDa至504kDa);此外,人丝聚蛋白拥有12段重复序列,具有早期截短突变体(重复序列较少)的患者不能够形成角质透明蛋白颗粒。
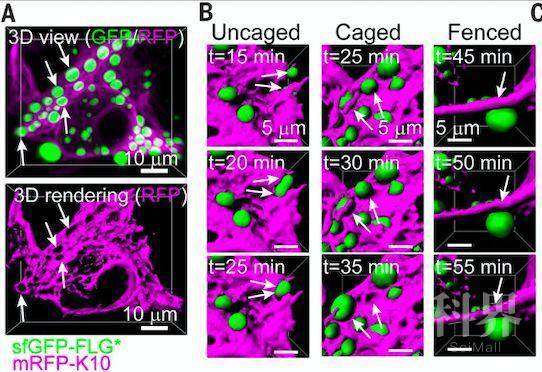
研究者首先在永生化的人角质形成细胞HaCAT细胞系中对丝聚蛋白截短突变体的相分离能力进行了观察:截短体重复序列数目大于等于4时,能够自发地形成类似于KG的foci结构(胞内丝聚蛋白浓度约为2uM);重复序列小于4时,则需要浓度在130-1500uM以上才能够形成。所有截短体形成的foci在激光漂白后均能够快速恢复,在活细胞成像中均可发生颗粒重排和融合事件,在原子力显微镜探针的压力下能够变形、在胞核周围形成类似液体的流。表明由丝聚蛋白驱动形成的角质透明颗粒为液体样行为,符合“液-液相分离”的特点。此外,截短体形成的foci在激光漂白后恢复时间短于全长蛋白所形成的foci,N-端截短体所形成的foci粘度显著低于全长蛋白所形成的foci。
接下来,研究者设计了融合荧光蛋白的可溶的内源无序客户蛋白(client),以实现在不干扰正常发育的情况下检测内生性相分离现象的目的。该客户蛋白自身不能够发生相分离行为,但能够通过与支架蛋白进行超弱的、特定于相分离的相互作用,准确定位内生性相分离的位置。研究者将该客户蛋白稳定转染到胚胎期9.5天小鼠的皮肤上皮内,通过整合素(Ivl)启动子控制该荧光传感器仅在上皮细胞分化过程中表达。
矢状共聚焦视图显示,荧光传感器信号仅局限于表达丝聚蛋白的颗粒层,而平面视图则显示这些细胞中有大量被荧光传感器标记的角质透明颗粒。活细胞成像显示,角质透明颗粒在细胞由基底层向颗粒层迁移的过程中逐渐形成、变大,且颗粒间有融合现象,表明其具有液滴性质。然而,大部分角质透明颗粒并非通过颗粒间的融合来长大,其液滴性质与HaCAT细胞系内外源性丝聚蛋白形成的颗粒有较大的差异。当角质形成细胞由基底层向颗粒层迁移时,大部分角质透明颗粒会发生形态学变化、粘度逐渐增加、激光漂白后的恢复时间也逐渐变长,提示迁移过程中可能有其他机制影响着丝聚蛋白的相分离。
颗粒层细胞一大特点是具有丰富的末端分化特异性角蛋白1和10(K1/K10)细丝网络,故此,研究者对K1/K10是否会参与到丝聚蛋白的相分离中进行了探索。实验结果显示,在颗粒层细胞中,角蛋白束完全包裹住了丝聚蛋白-角质透明颗粒,被包裹的角质透明颗粒显示出长期的惰性的活动能力;当角蛋白束不存在时,这些颗粒显示出较强的颗粒融合、变形等活动能力。终末分化特异性角蛋白的低复杂度结构域与角质透明颗粒间通过密度依赖的弱相互作用,形成稳定的液滴装角质透明颗粒和角蛋白丝束的精细交织网络。
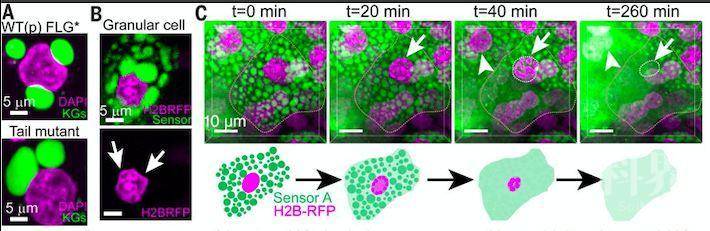
这一交织网络具有重要的生理意义:随着角质形成细胞由颗粒层逐渐向上迁移,角蛋白束稳定的角质形成颗粒逐渐变得愈发拥挤,这使得细胞核和其他细胞器变形,从而导致这些细胞器在颗粒层向角质层过渡的过程中被破坏掉,最终形成死细胞角质层。
胞核丢失、细胞鳞屑化的过程十分迅速,发生于2个小时以内,首先表现为染色质压缩,而后伴随着染色质丢失、胞核破坏、细胞器丢失。角质形成颗粒也在这一过程中逐渐溶解。研究者们对起始这一过程的因素进行探究,发现丝聚蛋白由于富含组氨酸,酸解离常数约为6.1,当角质形成细胞从颗粒层(pH=7.4)向角质层(pH=5.5)迁移时,酸碱环境的变化使得角质形成颗粒迅速解聚、溶解,这一过程释放的新的蛋白可能引发了染色质压缩(knock-out实验表明,后者是丝聚蛋白依赖的)。
至此,Elaine Fuchs院士团队完整勾勒出了丝聚蛋白在角质形成细胞中发生相分离、通过相分离动态调控细胞状态、驱动细胞分化迁移、最终形成角质层鳞屑细胞的生理过程。此外,还提供了一种研究内原性相分离的思路:通过整合本研究中的体内相分离传感器与为近距离蛋白质组学进化而来的酶,在不干扰内源支架蛋白的情况下,对类器官、组织和生物体内的内源性“液-液相分离”进行分子和生物物理研究。
最近疫情形势之严峻、COVID-2019的研究之火热,使得CNS的宠儿相分离研究略显逊色。Elaine Fuchs院士团队的研究为我们揭示了相分离重要的生理、病理意义,其形成与否更是直接关系到皮肤屏障障碍类疾病的发生发展。相分离研究已不仅仅停留在理论层面、实验室中、模式生物上,更是在向临床、病理迈进。能够应用到临床的研究才是好研究,相分离领域还有许多可待挖掘之处,有待后人发现。
附图一:被角蛋白丝束(K10,紫红色)包裹着的丝聚蛋白-角质形成颗粒(FLG,绿色)
附图二:角质形成细胞由颗粒层向角质层迁移过程中细胞形态变化(绿色:丝聚蛋白-角质形成颗粒;紫红色:染色质)
来源:BioGossip BioArt
原文链接:https://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652482596&idx=1&sn=9c90a4bb6e363b791adabb06d0a07c06&chksm=84e23f90b395b6861130f1773b1da2693e7bdf6ef59cc68bbd953986b3fa967f66a4c3737421#rd
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

伴有皮肤屏障损害的炎症性皮肤病是否增加了COVID-19的风险?

纳米颗粒喂蠕虫可探细胞力

人工设计病毒样颗粒可有效传递治疗性蛋白质
频繁使用祛斑美白产品,降低肌肤屏障作用,伤皮肤!

学术造假必遭严惩,为何仍不断有人冒险

新型多孔纳米颗粒可引导干细胞形成骨骼
从健康细胞到癌细胞,或许只需要几个突变
失去细胞核的细胞在3D环境中举步维艰
《细胞》发文!阿片类药物迎来重大突破
细胞角质蛋白19片段