科技工作者之家
科界APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-04-08
来源:BioWorld
CRISPR-Cas是原核生物中广泛存在的一种适应性免疫系统,用来清除外来遗传物质的入侵。而噬菌体病毒通过表达一类称之为Anti-CRISPR的蛋白来拮抗细菌体内的CRISPR-Cas免疫防御系统。Anti-CRISPR蛋白彼此之间序列同源性非常低,而且发挥功能方式也是多种多样的。到目前为止,超过20类的Anti-CRISPR蛋白得到了鉴定。其中,抑制I-F型CRISPR-Cas系统(也被称作Csy复合体)的Anti-CRISPR蛋白是最早被鉴定的,同时也是种类最多的(包括AcrF1-10)。
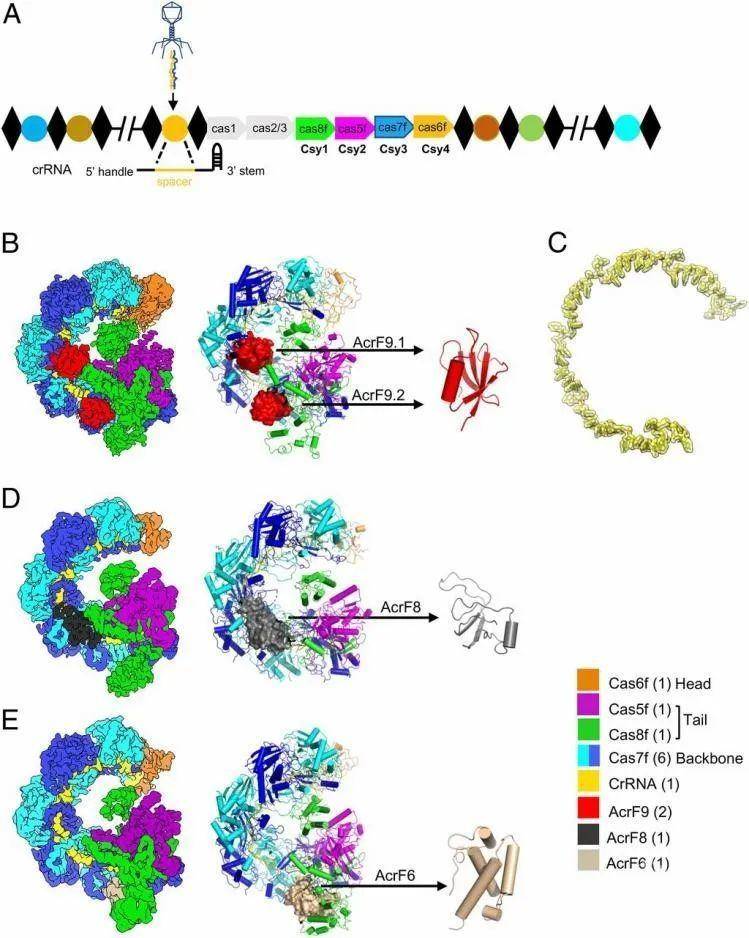 图2. 鉴定未知转运体策略
图2. 鉴定未知转运体策略https://www.pnas.org/content/early/2020/03/12/1922638117
来源:ibioworld BioWorld
原文链接:http://mp.weixin.qq.com/s?__biz=MzU1MzMxMzcyMg==&mid=2247498326&idx=7&sn=32135ec61540d1b264ee5d5b7855d080&chksm=fbf60e83cc818795585255f5471825afe58da9bfc43a05485d9b9d9f4fb30460a710bf6770a9&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
【复材资讯】科学家首次实现陶瓷4D打印

Nature黄志伟/高宁合作团队首次揭示人T细胞受体-共受体复合物组装的分子机制
导弹弹体结构系统
中国科学院海洋研究所十足目对虾总科分类与系统演化研究获重要进展

人体细胞内存在“铁路”系统,能自动优化结构
结构动力系统识别

中国海洋湖沼学会理事张奇研究员在“第十五届中美碳联盟(USCCC)年会暨陆域水体水-热-碳通量国际研讨会”上做大会主题报告
黄志伟课题组《Science》发文揭示人B细胞受体复合物组装的分子机制

科技丨美国国防高级研究计划局(DARPA)正寻求改变人工智能的工作方式

黄志伟实验室和北京大学高宁实验室合作揭示人T细胞受体-共受体复合物组装的分子机制