科技工作者之家
科界APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-04-09
来源:BioWorld
蛋白质分泌是细胞之间进行信息传递的核心方式之一。我们通常所指的分泌蛋白具有N端的信号肽序列,能够被信号识别颗粒(SRP)所识别并通过SEC61转运体(translocon)进入内质网腔,随后信号肽被切除,分泌蛋白经过加工和修饰,通过内质网-高尔基体(ER-Golgi)膜泡运输途径被运送到细胞外,该过程被称为经典分泌途径,其关键内容已经被写入细胞生物学教科书。
近年来研究发现,许多蛋白质的分泌不依赖于ER-Golgi的常规分泌途径,称为非经典分泌(Unconventional Protein Secretion, UPS)。大多数UPS蛋白不具有典型的信号肽,其分泌主要通过两种方式:(1)直接穿越细胞质膜(I型); (2)类似于经典分泌,需要膜泡运输介导(III型)。在III型UPS中,蛋白质需要进入一个膜泡载体(例如分泌性自噬体和溶酶体等),然后通过膜泡运输系统被运送到细胞外。由于缺少信号肽的导向,一个亟待解决的关键问题就是这类UPS货物是如何进入膜泡载体中的。
2020年4月8日,清华大学生命科学学院葛亮课题组在 Cell 杂志在线发表题为:A translocation pathway for vesicle -mediated unconventional protein secretion 的研究论文,该研究报道了一条介导UPS货物进入膜泡的蛋白跨膜转运分子通路。 促炎症因子IL-1β (interleukin-1β)是第一个被发现,同时也是研究最多的非经典分泌蛋白。IL-1β可通过I型和III型UPS分泌:I型途径中,IL-1β主要通过Gasdermin D(GSDMD)N末端片段在细胞质膜上形成的孔被释放;III型途径中,成熟型IL-1β (mIL-1β)被会运送到一个膜泡载体中。在之前的研究工作中,作者建立了一套分析mIL-1β分泌的细胞学系统,发现mIL-1β能够转运进一个中间膜泡结构并进入自噬体的双层膜结构之间,最终通过分泌型自噬被分泌到胞外,并且这一跨膜转运过程依赖于蛋白质的去折叠,这预示着存在一个类似translocon的膜通道(图1)。
促炎症因子IL-1β (interleukin-1β)是第一个被发现,同时也是研究最多的非经典分泌蛋白。IL-1β可通过I型和III型UPS分泌:I型途径中,IL-1β主要通过Gasdermin D(GSDMD)N末端片段在细胞质膜上形成的孔被释放;III型途径中,成熟型IL-1β (mIL-1β)被会运送到一个膜泡载体中。在之前的研究工作中,作者建立了一套分析mIL-1β分泌的细胞学系统,发现mIL-1β能够转运进一个中间膜泡结构并进入自噬体的双层膜结构之间,最终通过分泌型自噬被分泌到胞外,并且这一跨膜转运过程依赖于蛋白质的去折叠,这预示着存在一个类似translocon的膜通道(图1)。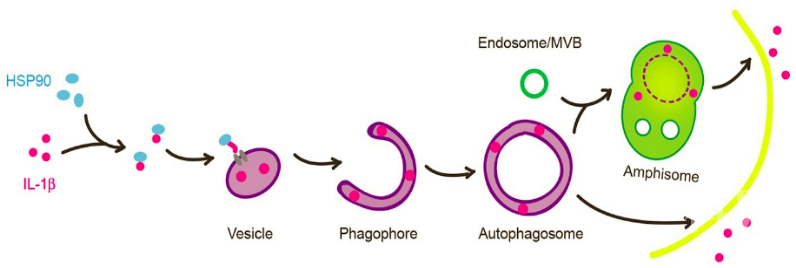 图1. IL-1β进入膜泡载体并通过分泌型自噬被分泌
图1. IL-1β进入膜泡载体并通过分泌型自噬被分泌
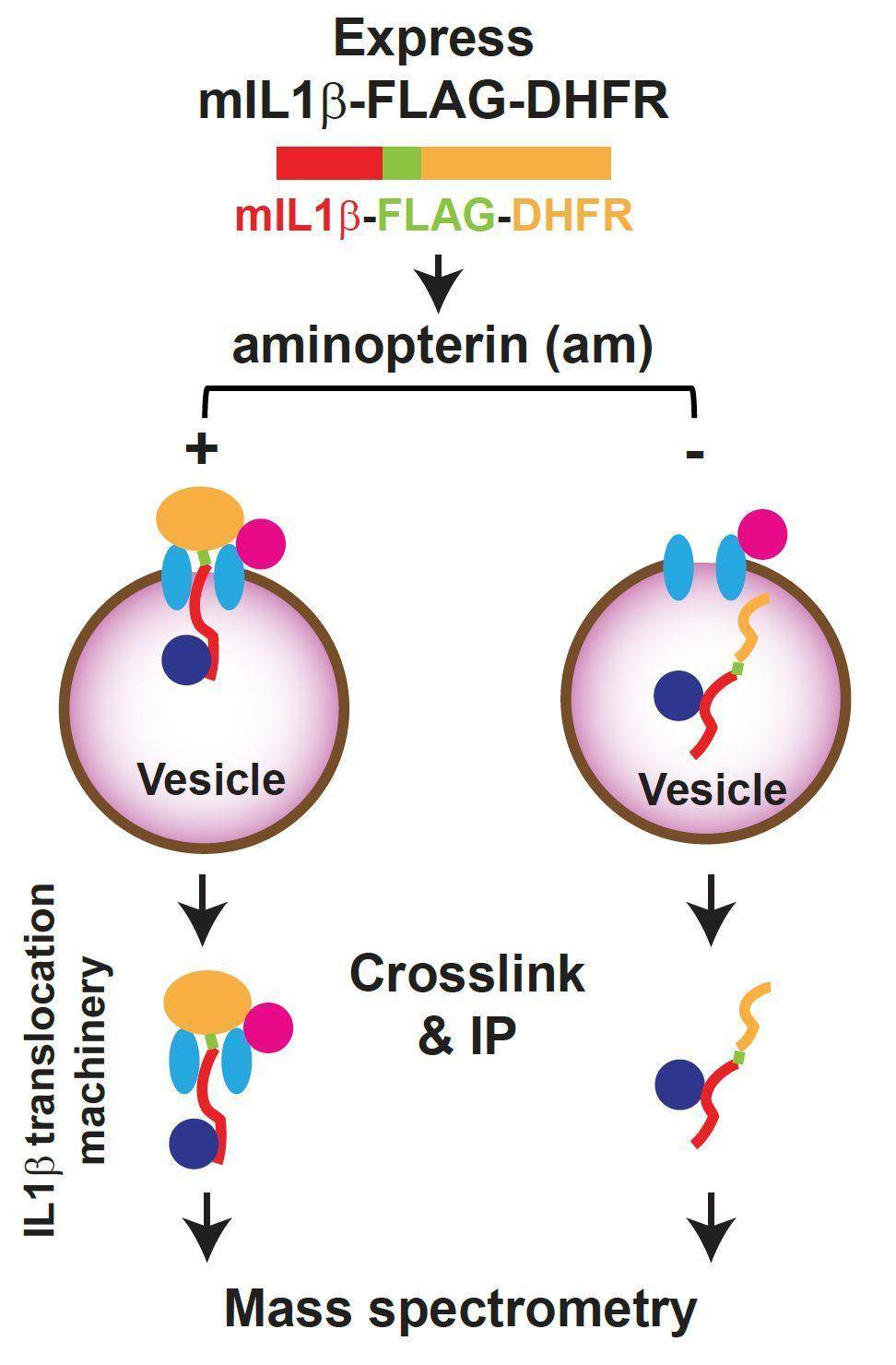 图2. 鉴定未知转运体策略有趣的是除了IL-1β外,非经典分泌蛋白IL-1家族其它成员(包括:IL-1α、IL-18、IL-33、IL-36、IL-37和IL-38)以及分子伴侣(HSP5B)、糖链结合蛋白(galectin 1和galectin 3)、 磷脂结合蛋白(Annexin A1)和神经毒性蛋白(Tau)的分泌也受TMED10调控,提示TMED10调控一系列UPS蛋白货物的分泌。
图2. 鉴定未知转运体策略有趣的是除了IL-1β外,非经典分泌蛋白IL-1家族其它成员(包括:IL-1α、IL-18、IL-33、IL-36、IL-37和IL-38)以及分子伴侣(HSP5B)、糖链结合蛋白(galectin 1和galectin 3)、 磷脂结合蛋白(Annexin A1)和神经毒性蛋白(Tau)的分泌也受TMED10调控,提示TMED10调控一系列UPS蛋白货物的分泌。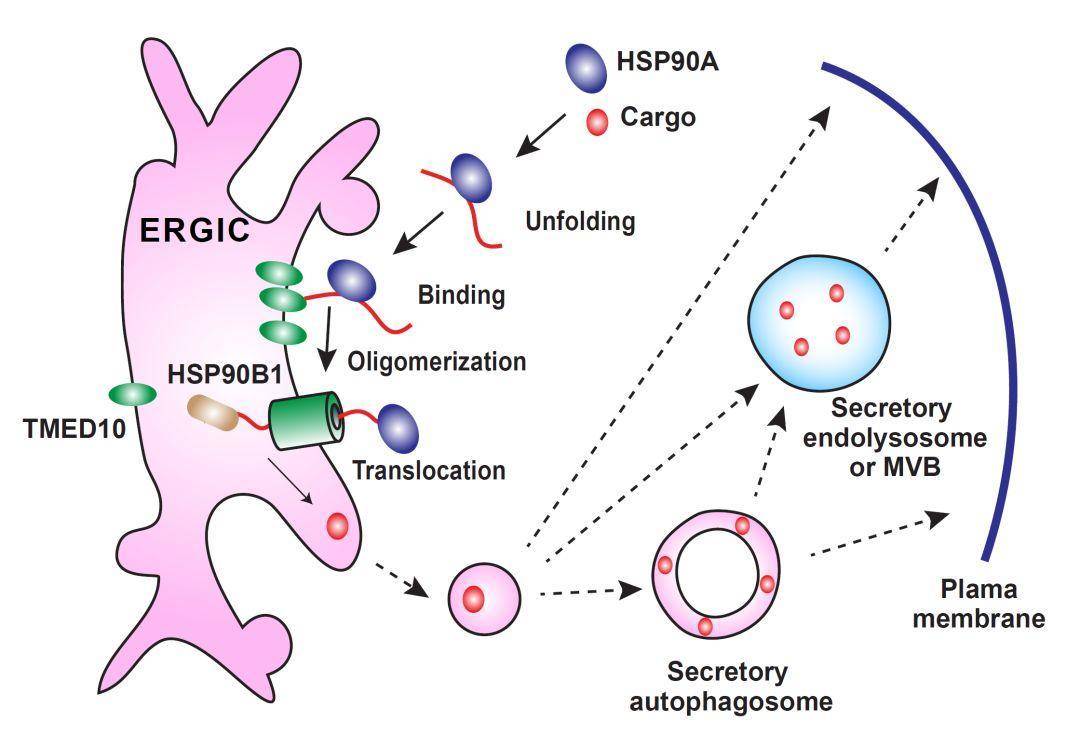 图3. TMED10介导的蛋白质非经典分泌途径工作模型该研究提示类似于经典分泌途径,非经典蛋白质分泌也存在一条(或者多条)蛋白质跨膜转运通路调节蛋白的分泌。在细胞内THUPS可能是SEC61介导的经典分泌跨膜转运的平行途径,调节非经典蛋白质分泌。该研究还处于初期,很多问题还需要进一步解答,包括:该通路的分子细节、THUPS相关非经典蛋白质分泌组以及生理意义等。据悉,这项研究由清华大学生命科学学院葛亮实验室完成,实验室张敏博士和博士生刘磊是文章的共同第一作者,葛亮研究员为通讯作者。
图3. TMED10介导的蛋白质非经典分泌途径工作模型该研究提示类似于经典分泌途径,非经典蛋白质分泌也存在一条(或者多条)蛋白质跨膜转运通路调节蛋白的分泌。在细胞内THUPS可能是SEC61介导的经典分泌跨膜转运的平行途径,调节非经典蛋白质分泌。该研究还处于初期,很多问题还需要进一步解答,包括:该通路的分子细节、THUPS相关非经典蛋白质分泌组以及生理意义等。据悉,这项研究由清华大学生命科学学院葛亮实验室完成,实验室张敏博士和博士生刘磊是文章的共同第一作者,葛亮研究员为通讯作者。论文链接:
https://www.cell.com/cell/fulltext/S0092-8674(20)30323-8#%20
来源:ibioworld BioWorld
原文链接:http://mp.weixin.qq.com/s?__biz=MzU1MzMxMzcyMg==&mid=2247498364&idx=4&sn=6d4b35015955cdd5566be2a7579d4bcd&chksm=fbf60ea9cc8187bfa0f3edc60eab64d5740cfec448939c09bf49fce03054e7345d735249b7b6&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

Cell | 中科院生物物理所张宏组再一次突破,在自噬领域取得重大进展
新型蛋白质组学分析技术可以原位、动态、3D水平揭示蛋白质结构变化与生物学过程

人工智能预测蛋白质结构(新知)
新型蛋白质组学分析技术可以原位、动态、3D水平揭示蛋白质结构变化与生物学过程

CopulaNet:深度学习蛋白质结构预测新进展
蛋白质之间发生了什么?

自然中不存在的蛋白质也能人造了!撼动材料医药界
铁氧反应为科学家提供了肺癌治疗新思路

能设计新蛋白质的AI再现突破,生成在天然蛋白质中从未见过的拓扑结构
王志珍会长致2015年国际蛋白质学会“青年科学家奖”获奖者颜宁的贺信