科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-12-25
来源:植物科学最前沿
蛋白质组是指在某一特定时间,特定条件下,某一特定组织中表达的所有蛋白质。基于质谱技术的蛋白质组学研究能够在一定范围内检测某一组织中的蛋白质组分和含量。然而许多生物过程是通过分子间的相互作用和化学修饰来调节的,对蛋白质丰度水平变化影响不大,无法使用传统的蛋白质组学进行鉴定。近年来开发出许多新型的蛋白质组学,例如磷酸化蛋白质组学、互作组学和基于活性的蛋白质组学可以捕获影响蛋白质功能的特定分子事件,但通常报告类型单一,无法进行大范围内对不同的调控事件进行高通量分析。基于此,瑞士苏黎世联邦理工大学生物系分子系统生物学研究所Paola Picotti教授团队开发出一种新型的蛋白质组学技术LiP-MS,并在Cell上发表题为“Dynamic 3D proteomes reveal protein functional alterations at high resolution in situ”的文章,介绍了LiP-MS技术可在整个蛋白质组范围内监测蛋白质的结构变化,其分辨率可精确定位单个功能位点。

作者首先通过对处于指数生长状态的酵母施加渗透胁迫或热胁迫研究短时间内酵母中激活的细胞反应,在处理后提取蛋白质组,并进行LiP-MS,对蛋白质的丰度和结构变化进行同时测定。LiP-MS是利用有限蛋白水解技术与定量质谱分析结合的蛋白质组学分析方法,当化合物与蛋白质结合时会诱导靶标蛋白的特定结构改变,这种结构变化会改变蛋白水解模式,可利用HRM质谱检测。通过独立的数据采集,无标签定量分析得到了肽混合物,利用已有数据库进行校正后获得结构特异性的蛋白水解指纹图谱。结果表明与之前研究一致,在短时间刺激下,发生丰度变化的蛋白质仅占总蛋白的1%,而发生结构变化的蛋白质分别在热激和渗透压刺激下为23%和11%。为了验证这些结构发生变化的蛋白质是否是由刺激响应引起的,作者对这些蛋白质进行功能富集分析,与先前结果一致,证明该方法的可靠性。
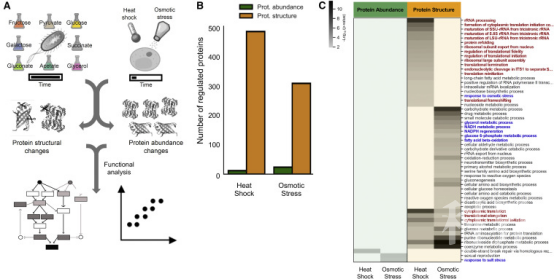
图1酵母和大肠杆菌中细胞反应过程中的总体蛋白质结构和丰度变化
作者通过对结构发生改变的蛋白质进行分析发现,它们和已报导过的酵母对渗透压胁迫的途径类似,同时找出12种在渗透应激条件下结构发生明显改变的激酶或磷酸酶。由于在渗透应激反应期间MAPK途径中发生了一些磷酸化事件,因此作者将LiP-MS数据与磷酸化蛋白质组学分析进行比较,发现有48种磷酸化蛋白在刺激后结构发生了改变。根据磷酸蛋白组学数据和已知的激酶/底物关系,鉴定到了其中11种酶的14种已知靶蛋白的结构变化和磷酸化改变,这些结构变化可以通过改变特定激酶和磷酸酶的上游活性来解释。同时,作者也对热激后发生结构变化的蛋白进行分析,研究LiP-MS报告蛋白质-蛋白质相互作用的能力。已有报道表明在热激刺激后有177种蛋白质会由于蛋白质/ RNA复合物的聚集,错误折叠或形成沉淀,这些蛋白质被称为聚集体。通过LiP-MS检测到在177个聚集体种有96个显示出结构变化,其中仅有4个显示出丰度变化。作者通过超速离心实验来确定LiP-MS是在热激时检测到聚集或者聚集之前的结构变化,结果显示对不溶部分和可溶部分中聚集器的LiP-MS分析可以精确的推定假定的聚集界面。最终结果表明,结构读数可以捕获热激酵母后蛋白质聚集的变构调节现象。
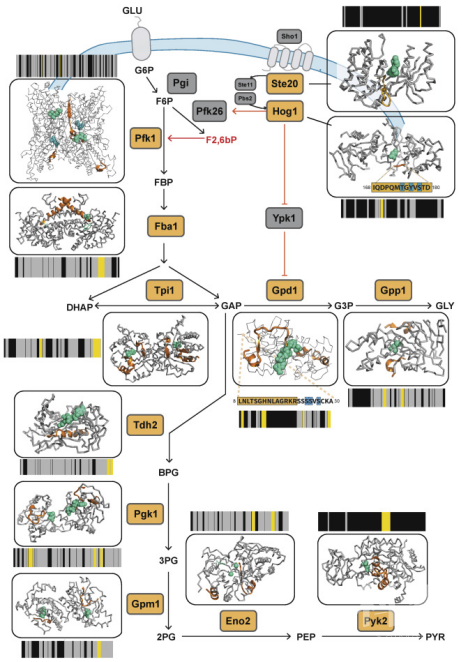
图2酵母对渗透压响应的多个调控事件
在大肠杆菌系统中,作者研究了在8种不同碳源中生长的大肠杆菌,在相同的生长条件下,代谢产物水平通常和大肠杆菌中央碳代谢(CCM)的通量表现出条件依赖性。作者认为通量变化可以代表酶功能状态的改变,并用此来评估结构读数报告CCM功能变化的能力。与葡萄糖生长条件下相比,不同条件下生长的大肠杆菌平均有365种蛋白质经历了结构变化,190种蛋白质发生了丰度变化,和酵母中情况类似,发生结构变化的蛋白质多于丰度变化。
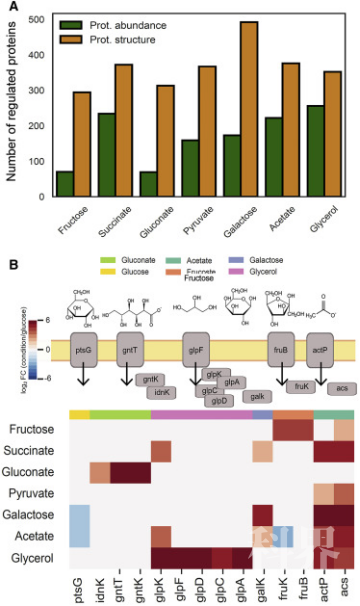
图3大肠杆菌中的总体蛋白质结构和丰度变化
为了评估发生结构变化和丰度变化的蛋白质信息关系,作者分别对它们进行功能富集分析,发现在糖酵解途径中未富集到丰度变化的蛋白质,与之前研究结果一致,即糖酵解通量改变不是由转录水平起主要作用。相反,在20种已鉴定的糖酵解酶中有16种显示出结构变化。不同的调控机制控制着生长在不同碳源上的大肠杆菌CCM的不同分支,糖酵解受影响蛋白质结构而非基因表达的调控机制控制,而TCA和乙醛酸循环除了影响蛋白质结构的调控过程外,还受到蛋白丰度的影响。
对于特定的酶促反应,反应通量的变化可能是由于酶活性,底物浓度或酶含量的变化导致的。作者推测酶活性改变或与反应物结合改变导致的通量变化可能会影响蛋白质结构而产生LiP信号。通过线性回归测试研究在8种条件下酶的结构变化或丰度变化与代谢通量变化的相关性。基于此,作者假设代谢物FBP可与大肠杆菌ptsl酶的活性位点结合。首先,通过计算分析表明FBP可能是ptsl的竞争性抑制剂,FBP的两个磷酸基团与辅因子Mg 2+配位,与ptsI的Glu431和Asp455的带负电荷的侧链以及周围的水分子一起形成八面体配位系统。而体外实验证实FBP降低ptsI活性。先前研究表明ptsI控制己糖摄取并调节糖酵解流量,有趣的是,FBP被证明是一种细胞内糖酵解流量传感器,因此,作者假设FBP-ptsI相互作用是一个负反馈回路,在糖酵解中间产物已经很丰富的情况下,可以防止过量的葡萄糖摄取,随后作者也通过实验验证这一观点。作者认为体内发生的相互作用应该在代谢转变期间显示体外定义的标志物肽的变化,其中特定代谢物的内源性浓度发生了显着变化。作者确定了121种此类代谢物与蛋白质的相互作用,其中有9种已被报道。
生物过程是由分子间相互作用和化学修饰来调节的,对蛋白质表达水平影响不大,传统蛋白质组学无法检测出其中的变化。LiP-MS技术可以通过对蛋白质结构读数变化原位检测蛋白质功能变化,本文提出将不同条件下的蛋白质组动态原位结构数据,将扩展结构系统生物学和链接系统以及简化方法的潜力。通过将动态和高分辨率的结构数据与功能联系起来,使得细胞功能的3D模型构建更加完善。
来源:frontiersin 植物科学最前沿
原文链接:http://mp.weixin.qq.com/s?__biz=MzIyOTY2NDYyNQ==&mid=2247506155&idx=5&sn=4e9f6fda5029ac72685a6e047a2087f9
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

自然中不存在的蛋白质也能人造了!撼动材料医药界
蛋白质纤维

中国科学院海洋研究所第四纪以来亚洲夏季风演化研究取得重要进展
AlphaFold 2再发350000种蛋白质结构预测结果,解锁98.5%人类蛋白质组!

丙肝病毒关键蛋白质结构图绘成

人体细胞内存在“铁路”系统,能自动优化结构
【复材资讯】科学家首次实现陶瓷4D打印

地理快讯|全球变化科学研究数据出版系统"获得第八届中国数字出版博览会"创新项目"荣誉
从预测进化 AI能“构想”新蛋白质结构
苍蝇体内独特蛋白质相当人类中间丝状蛋白质