来源:X一MOL资讯
大家知道南美叶状毒箭蛙的皮肤能分泌致命的毒液,因此土著人经常以这些蛙类的毒液涂在箭头和标枪上,用来猎杀猴子等小型哺乳动物。1969年从这种箭毒蛙的皮肤中分离得到一种具有高度氧化态的甾体生物碱—(–)-batrachotoxin,并进行了结构鉴定,成为人类已知的最具毒性的物质之一。
该分子具有特殊的生物活性,它能稳定电压门控钠(NaV)通道,因此被广泛用作研究离子输运。与它一起分离得到的还有家族分子(–)-batrachotoxinin A(与batrachotoxin区别在于分子中C20羟基连接的侧链不同),虽然其效力明显较低,但可以很容易地转化为batrachotoxin或其他类似物,用于不同目的的NaVs研究。
由于(–)-batrachotoxin复杂的分子结构及独特的生物活性,因此在化学及生物学领域引起了广泛的关注。
早在1972年,Imhof 团队就开始了对该家族分子的合成研究,并以11α-acetoxyprogesterone为起始原料完成了batrachotoxinin A的半合成;1998年,Kishi 课题组完成了batrachotoxinin A消旋体的合成;之后有许多关于合成该家族分子的工作汇报,直到2016年,Du Bois团队利用自由基串联反应,以(+)-Hajos-Parris酮为起始原料,24步首次实现了(–)-batrachotoxin的不对成合成,研究并得出batrachotoxin、对映体及其多个类似物的在NaV功能上有差异的结论(Science, 2016, 354, 865-869, 点击阅读详细)。本文主要介绍罗佗平课题组最新发表在JACS 上关于(–)-batrachotoxin的全合成工作。
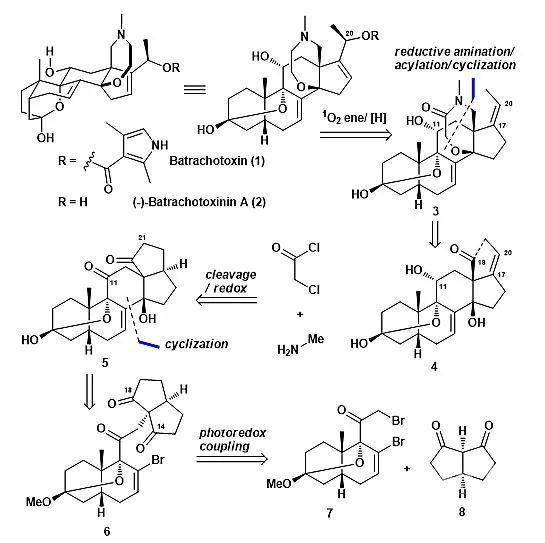
图1. 逆合成分析。图片来源:罗佗平课题组从逆合成分析我们知道,首先,利用中间体3中C17-C20位的双键,通过激发后的单线态氧的ene反应,在合成最后期引入batrachotoxin分子中C20位的羟基;5-6并环处的七元内酰胺环,由中间体醛4经过还原胺化、酰化、环化等操作构建,C11位的α羟基通过同时立体选择性还原得到;通过切断关键中间体5中的C18-C21键,构建5-6并环,同时引入后期反应所需的双键及醛基;采用去对称化策略,利用光氧化还原偶联反应将溴化物7和C
s对称二酮8连接起来,是整个合成中关键的一步,再通过分子内的环化反应构建并环骨架;对映异构体7由已知化合物9通过3步反应转化得到;(+)-Hajos-Parrish酮作为最起始的原料,带入天然产物中的顺式6-6并环及必须的官能团。

图2. 去对称化策略及光氧化还原偶联反应制备关键中间体14。图片来源:罗佗平课题组首先,(+)-Hajos-Parrish 酮经过选择性酮羰基保护及烯酮α位溴代,得到起始原料烯酮9;通过分子构象控制的高立体选择性的亲核加成反应,得到单一的非对映异构体10;樟脑磺酸和甲醇条件下,化合物10生成分子内笼状缩酮;TMSOTf和三乙胺将C11位酮转化为烯醇硅醚,再用NBS氧化得到化合物7。
通过光氧化还原偶联反应将化合物7和8连接起来,最终实现克级制备溴化物6。作者通过计算化学对该反应进行了详细分析(见supporting information),得出生成产物5和12在过渡态能量上存在差异,生成顺式5-6并环产物5是优势的。在-98℃条件下用tBuLi (4 equiv)可以实现6-6并环骨架的构建,并分离得到目标化合物5,并通过单晶确定了所有的立体化学,反应中脱溴是主要的副反应,同时伴随有少量异构体12(dr = 3:1);由于化合物5容易发生逆Aldol反应,TMSOTf和三乙胺的条件下不仅将游离的三级醇保护成硅醚,环戊酮单元转化成更富电的烯醇硅醚14。当量的OsO4将烯醇硅醚14氧化后,PbOAc4切断C18-C21键,顺利得到醛16;虽然还原胺化顺利引入C18位氨甲基,但C11的羰基被还原生成不希望的β-羟基,后续需要翻转C11的手性中心,因此需要寻找其他的合成策略来实现还原胺化,同时获得C11位正确的立体化学。

图3. (–)-Batrachotoxinin A (2)的全合成。图片来源:罗佗平课题组
烯醇硅醚14通过Saegusa氧化得到烯酮18,接着DIBAL-H从位阻小的一侧将烯酮1,2-还原到醇;加入过量的LiAlH4,通过羟基导向的还原,得到C11位α羟基,同时脱除TMS。将C14和C18位的羟基保护,O3将位阻小的二取代双键氧化,原位用NaBH4还原得到三醇化合物21。
为了引入C17-C20位的双键,首先酸性条件下发生transketalization反应,将C18和C21的羟基保护起来;利用Grieco-Nishizawa条件顺利引入C17-C20位的双键;然后通过脱保护和NaIO4氧化一锅操作,得到24。通过还原胺化、乙酰化和分子内环化生成七元内酰胺25,这样就完成天然产物整个的分子骨架。单线态氧的ene反应后加入Ac2O,分离得到C11位乙酰化的产物,同时回收未反应的原料25(19%)。高立体选择性的格氏试剂1,2-加成,成功引入C20位的甲基(dr = 6:1);最后用LiAlH4还原内酰胺得到天然产物(–)-batrachotoxinin A (2)。
总结
作者以(+)-Hajos-Parrish 酮为起始原料,带入顺式-decalin结构及必要的官能团,利用去对称化策略及光氧化还原偶联反应生成四环骨架结构,通过还原胺化及多步氧化还原操作得到天然产物(–)-batrachotoxinin A (2)。
本文在合成上借鉴了Du Bois课题组(Science, 2016, 354, 865–869)和Masayuki Inoue课题组(Org. Lett., 2018, 20, 130-133)的经验,完成了(–)-batrachotoxinin A的不对称合成,并发展了还光氧化还原偶联反应在全合成中的运用,为(–)-batrachotoxin(1)及其类似物的研究提供了可能。
原文:Total Synthesis of (-)-Batrachotoxinin A: A Local-Desymmetrization ApproachYinliang Guo, Zhixian Guo, Jia-Tian Lu, Runting Fang, Si-Cong Chen, Tuoping Luo*J. Am. Chem. Soc., 2020, 142, 3675-3679, DOI: 10.1021/jacs.9b12882
来源:X-molNews X一MOL资讯
原文链接:http://mp.weixin.qq.com/s?__biz=MzAwOTExNzg4Nw==&mid=2657632935&idx=4&sn=2141473fc86afa957b98a491383e7219&chksm=80f86b77b78fe26161f48a2f1f0663a797949cdf248424d34f0d14df04de65ed9deafd47a48e&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn