科技工作者之家
科界APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-04-18
来源:BioArt
撰文 | 咸姐
流行性感冒(流感)是由流感病毒引起的全球性严重传染性疾病。流感病毒属于正粘病毒科流感病毒属,是一种RNA病毒。流感病毒的基因组由8个单负链RNA片段(病毒RNA,vRNA)组成,共编码了11个蛋白,其中,流感病毒RNA聚合酶是由前3个片段所编码的。流感病毒RNA聚合酶是由酸性蛋白(PA)、碱性蛋白1(PB1)和碱性蛋白2(PB2)三个亚基组成的异源三聚体复合物,PB1亚基主要参与病毒基因组的复制过程,而PB2亚基主要负责与宿主pre-mRNA帽状结构结合,协助完成内切酶的剪切过程。流感病毒RNA聚合酶与核蛋白(NP)、vRNA一起构成核糖核蛋白体(vRNP)。流感病毒进入宿主细胞后,vRNP被运送到细胞核与转录中的Pol Ⅱ结合,病毒聚合酶开始进行“初级”转录,产生病毒mRNA,进而合成病毒蛋白【1,2】。
由于病毒蛋白质的合成依赖宿主细胞的翻译体系,流感病毒mRNA需要同时具备可供宿主细胞翻译体系识别的5’-帽状结构和3’-poly(A)尾,因此病毒mRNA的转录是通过一种独特的称为“抢帽”(cap-snatching)的过程发生的,在这个过程中,来自宿主pre-mRNA的短帽寡聚物(长度约为10-15 nt)被PB2亚基“抢夺”,在PA亚基中被内切酶裂解,然后被PB1亚基用于启动mRNA的合成。病毒RNA聚合酶在vRNA 5’-端附近的寡聚-U延伸处的停顿,导致了自身聚腺苷酸化。
因此,翻译能力强的病毒mRNA不需要病毒编码的加帽酶,也不需要宿主的聚腺苷酸机制。整个复制过程包括将vRNA准确的全长拷贝不经修饰的合成为互补RNA(cRNA),然后逆转回子代vRNA。初生的复制体会立即与核蛋白整合在一起,形成完整的vRNP或互补RNP(cRNP)。
相反,病毒的mRNA则并没有被这样包装,而是被当作宿主的pre-mRNA被进一步剪接,并通过宿主的细胞机制输出到细胞质中【3】。此外,有研究发现,一个单一的初级vRNP可以在没有额外的病毒成分的情况下进行转录【4】,而在翻译抑制剂放线菌酮存在的情况下病毒mRNA持续积累也表明单个vRNP可以进行多轮转录【5】。在真正的流感病毒感染过程中,这种潜在的高效回收机制与从相对较少的vRNP中快速生成大量病毒mRNA的需求是一致的。
由此可见,流感病毒mRNA的转录过程有着其独特且复杂的机制,尽管多年的研究逐渐揭开了这一过程的部分面纱,但是从整体上全面而完整的了解流感病毒mRNA的转录过程仍然是解读流感及开发流感有效药物的必要过程。
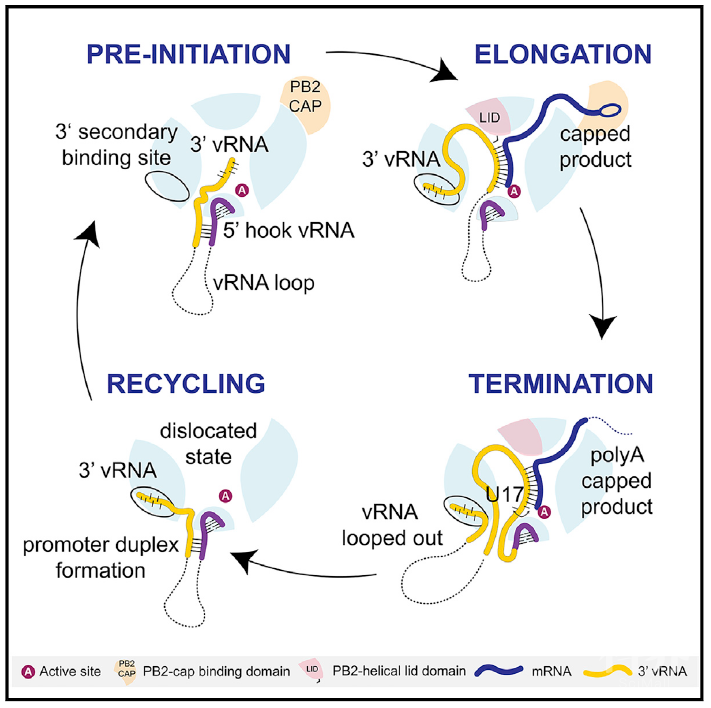
2020年4月17日,来自法国欧洲分子生物学实验室的Stephen Cusack研究团队在Cell上在线发表题为 A Structure-Based Model for the Complete Transcription Cycle of Influenza Polymerase 的文章,基于转录活跃的蝙蝠A型流感(FluA)聚合酶的高分辨率冷冻电镜结构,提出了流感聚合酶合成mRNA的整个转录周期的详细机制模型,该结构涵盖了从转录起始前到延伸和终止的整个转录周期,以及产物分离和模板再循环利用,为改善靶向流感病毒mRNA合成过程的抑制剂的设计提供了重要的基础。

本文的研究人员在率先添加了ATP和GTP,随后添加了CTP和一个不可水解的UTP模拟物(UpNHpp)后,利用一个延伸的18+3碱基长度的模板、带帽的15碱基的引物和14碱基长度的vRNA 5’-端激活的“挂钩”序列,建立了在模板转位后使RNA聚合酶停止的方法,通过冷冻电镜技术,获得了转录中的RNA聚合酶在不同连续状态中的结构(图1)。
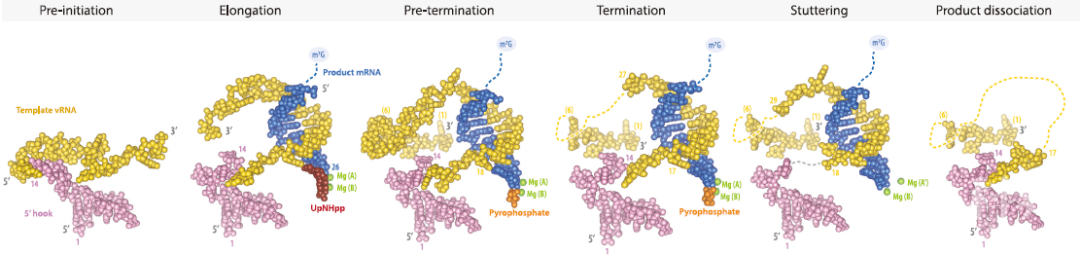
图1 流感病毒RNA聚合酶转录周期的结构
将延伸状态与启动前状态的结构进行比较发现,蝙蝠FluA聚合酶的启动-延伸转变表现出与先前描述的FluB聚合酶相同的特征构象变化,这些变化包括:1)启动回路的完全挤压和模板出口通道的开启;2)涉及PB1 β-功能区大约28°旋转的启动子折叠;3)PB1/667-681重新折叠并形成带有β-功能区的三股片层;4)PB1拇指结构域和相关的PB2-N结构域向外旋转约5°;5)置换PB2/37-44,允许双相延伸;6)通过在最后一对双重碱基上堆叠PB2 lid结构域Tyr205和PB1/Arg706实现双链分离。
这个结构揭示了流感病毒RNA转录重要的新特性。首先是模板从5’-端“挂钩”到活性位点的有序直接连接;其次是观察到了模板沿着出口通道前进并绕过PB2-N1结构域,通过活性位点转位后,其3’-末端的5个核苷酸重新结合到聚合酶PB1拇指和PA-C结构域之间的部分隐藏的“口袋”中,即二级3’-末端结合位点。
此外,这一系列结构精确地解释了流感mRNA聚腺苷酸化的停顿和滑脱机制,即第17位尿苷在活性位点+1的位置上来回翻转进出,活性位点空腔中的模板的长度在每一轮ATP结合之间存在9-10个碱基之间的交替而没有任何净移位。
因此,与延伸过程中的常规转位相反,在聚腺苷酸化时,只有产物从活性位点腔中转出。与此同时,该结构显示,通过在mRNA合成过程中紧紧抓住模板的两端,流感病毒聚合酶既能保护模板不被降解,又能有效地回收模板,改造启动子,并启动下一个转录周期,从而使得一个RNP可以高效地产生多个mRNA。
综上所述,根据广泛的、高分辨率的冷冻电镜结构数据显示的连续的流感病毒RNA聚合酶在转录过程中的结构,本文提出了一个全面且连贯的流感病毒RNA聚合酶完整的转录周期模型,对流感病毒模板经过活性位点后的轨迹、聚腺苷酸化的机制以及模板的回收是如何发生的有了新的认识,从而为流感的治疗提供了新的思路和方向。
原文链接:
https://doi.org/10.1016/j.cell.2020.03.061
参考文献
1. AREA E, MARTIN J, GASTAMINZA P, et al. 3D structure of the influenza virus polymerase complex:localization of subunit domains[J].Proc Natl Acad Sci USA, 2004, 101 (1) :308-313.
2. ENGELHARDT O G, FODOR E. Functional association between viral and cellular transcription during influenza virus infection[J].Rev Med Virol, 2006, 16 (5) :329-345.
3. Reich S, Guilligay D, Pflug A et al. Structural insight into cap-snatching and RNA synthesis by influenza polymerase. Nature. 2014, 516(7531):361-6.
4. Jorba, N., Coloma, R., and Ortı´n, J. Genetic trans-complementation establishes a new model for influenza virus RNA transcription and replication. PLoS Pathog. 2009, 5, e1000462.
5. Vreede, F.T., Jung, T.E., and Brownlee, G.G. Model suggesting that replication of influenza virus is regulated by stabilization of replicative intermediates. J. Virol. 2004, 78, 9568–9572.
来源:BioGossip BioArt
原文链接:https://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652483481&idx=3&sn=faff3c1913bb2600f82cc4b201c2898a&chksm=84e23c2db395b53bf8c9b5638b4a8e39d8822ee649647b0d18e6488619608f6bcf5d64e081a3#rd
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

健康卫士 有球必应丨流行性感冒

10月份健康提示: 注意预防新冠肺炎、手足口病、流行性感冒

我国首个P4实验室正式运行,致力于最危险病毒研究

最新研究:流感病毒有望得到遏制
刘实团队报道流感病毒感染过程中炎症与糖代谢交互调控

评论:“坏兔子”病毒闹心,怎样才能将网络恶棍拦在门外
副流感病毒抗体
范海天等揭示宿主因子ANP32A介导流感病毒复制酶的组装
流感病毒抗体
流感病毒抗体