科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-11-19
来源:BioArt
流感病毒是危害公众健康的重要病原之一。病毒基因的转录(transcription)与复制(replication)都是通过病毒RNA聚合酶(FluPol)来完成,同时需要不同宿主因子的参与。FluPol是一个由三个亚基(PB1,PB2,PA)组成的复合物。在病毒基因的转录过程里,FluPol与宿主RNA聚合酶II的C末端 (Pol II CTD)相互作用,之后掠取一段宿主信使RNA(mRNA)的帽子结构(5’ cap)作为合成病毒基因mRNA的引物。而在基因的复制过程中,聚合酶首先利用病毒自身的负链RNA(vRNA)作为模板复制出正链RNA(cRNA)中间物,再由此中间物作为模板复制出更多的vRNA(详见BioArt报道:Nature | 范海天博士等揭示流感病毒基因复制的重要机制)。这些正链和负链RNA都包被在核糖核酸蛋白复合体(RNP)中,在RNP复合物里,RNA的5’和3’末端与FluPol结合,中间部分则被核蛋白(NP)所环绕(图1)。在病毒基因的复制过程中,需要游离的FluPol参与进来并与新生的RNA的5’末端结合,作为新生RNP组装的起点。但截至目前,流感病毒复制酶如何组装,游离的FluPol如何参与,尚不清楚。此外,人们发现宿主因子同样参与病毒基因的复制,一种重要的流感病毒宿主因子—酸性核磷酸蛋白32家族(ANP32A/B),对于病毒基因的复制过程不可或缺【1】。然而,ANP32蛋白如何支持FluPol的活性,二者的相互作用是怎样实现的,这些都有待解答。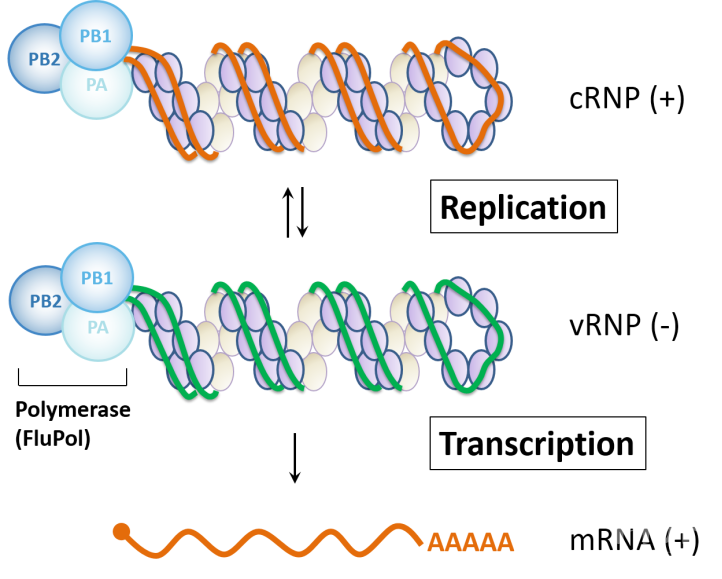
图1:流感病毒的基因转录与复制。
2020年11月18日,牛津大学的Jonathan M. Grimes和Ervin Fodor研究组合作(共同一作为Loïc Carrique博士,范海天博士,Alexander P. Walker和Jeremy R. Keown博士)在Nature杂志上在线发表了题为“Host ANP32A mediates the assembly of the influenza virus replicase”的文章。该文报导了C型流感病毒RNA聚合酶与人源或者鸡源ANP32A蛋白复合物的电镜结构。这些结构揭示了流感病毒复制酶(Replicase)如何组装,以及宿主因子ANP32A如何介导流感病毒基因复制。  在FluPol-ANP32A复合物的结构中,ANP32A蛋白介导两个FluPol分子组装成一个不对称的二体结构(图2)。两个FluPol分子的构象也不完全相同。ANP32A通过与柔性结构域的相互作用,将其中一个FluPol分子(称之为FluPolR)稳定在一种特异的构象,这种构象不能支持病毒基因的转录,表明ANP32A可以促使FluPol行使病毒基因复制的功能。另一个FluPol分子(称之为FluPolE)通过与ANP32A的相互作用,折叠成一种全新的构象。该分子PB2亚基的C末端柔性结构域倒向PA亚基(在C型流感病毒中称为P3亚基),进而可以与第一个FluPol分子的PB2亚基的C末端产生相互作用。
在FluPol-ANP32A复合物的结构中,ANP32A蛋白介导两个FluPol分子组装成一个不对称的二体结构(图2)。两个FluPol分子的构象也不完全相同。ANP32A通过与柔性结构域的相互作用,将其中一个FluPol分子(称之为FluPolR)稳定在一种特异的构象,这种构象不能支持病毒基因的转录,表明ANP32A可以促使FluPol行使病毒基因复制的功能。另一个FluPol分子(称之为FluPolE)通过与ANP32A的相互作用,折叠成一种全新的构象。该分子PB2亚基的C末端柔性结构域倒向PA亚基(在C型流感病毒中称为P3亚基),进而可以与第一个FluPol分子的PB2亚基的C末端产生相互作用。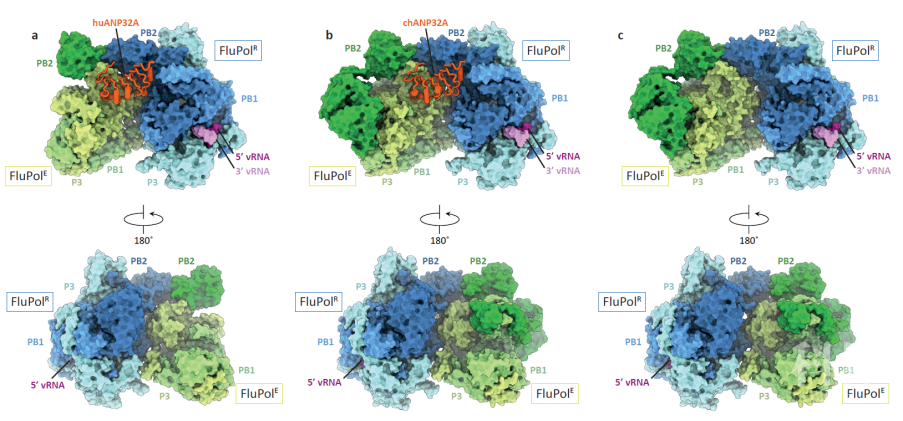
图2:流感病毒聚合酶和ANP32A复合物的电镜结构:a, FluPol和人源ANP32A的复合物结构;b, FluPol和鸡源ANP32A的复合物结构;c, 缺失ANP32A时FluPol可以组装成相同的二聚体结构。
后续功能实验验证了在这些结构中的相互作用结合面对于病毒基因的复制非常重要。对于关键位点氨基酸残基的突变大大降低了FluPol的活性。这种FluPol的二聚体聚合方式使得FluPolE的RNA结合位点非常靠近FluPolR的复制产物出口处(图3)。换句话说,如果FluPolR作为复制酶(Replicase)对病毒RNA进行复制,新生成的RNA可以快速地转移到FluPolE的RNA结合位点,从而避免生成裸露的病毒RNA被宿主识别,进而引发自身免疫反应。所以FluPolE起到了接收新生RNA的作用,提供了一个供后续RNP的组装(encapsidation)的平台。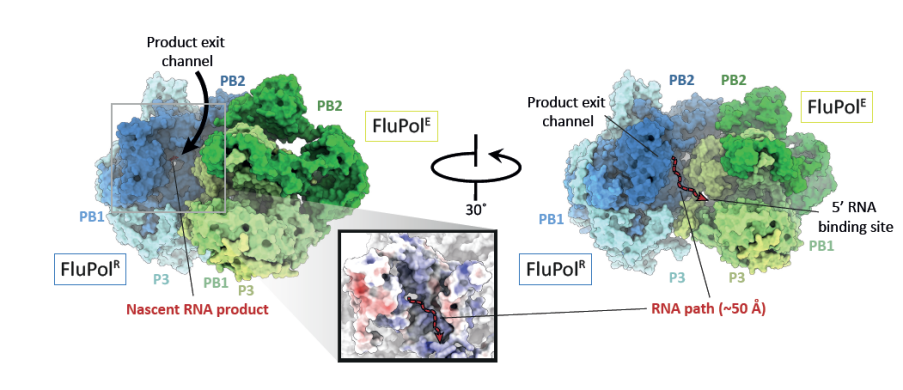 图3:经由FluPolR复制生成的新生RNA可以被FluPolE捕捉。
图3:经由FluPolR复制生成的新生RNA可以被FluPolE捕捉。
此外,之前的研究表明,ANP32A/B在流感病毒的跨物种传播中起到重要作用。一般来说,禽流感不能跨种传播哺乳动物。研究表明禽类的ANP32蛋白有一段33个氨基酸残基的重复插入序列,这一插入序列对于支持禽流感的活性是至关重要的。人类ANP32蛋白缺少了这段插入序列,因而不能支持禽流感的活性【2】。所以流感病毒需要通过突变自身的序列来适配人类的ANP32蛋白。一个重要的跨种氨基酸残基位于FluPol的PB2亚基上的627位。在禽流感中这一残基是谷氨酸(E),而在人类流感病毒中则突变为赖氨酸(K)。人们发现这一单点突变可以使得流感病毒利用人类细胞中的ANP32蛋白,进行基因的复制。
本文的作者尝试通过结构阐明这一过程。在FluPol和鸡源ANP32A复合物的结构中,可以看到有一小段ANP32A的密度插入到两个FluPol分子的PB2亚基中间,并且与627位残基有相互作用。这一段密度对应的基因序列正好位于鸡源ANP32A的重复插入序列中,根据长度推算属于一段酸性和碱性氨基酸残基混合的区域。人源的ANP32A蛋白由于缺少了这段插入序列,所对应的基因序列属于一段只含有酸性氨基酸区域。这就解释了为什么鸡源的ANP32A蛋白可以同时支持627位E和K的FluPol,而人源的ANP32A蛋白只能支持627位E的FluPol(图4)。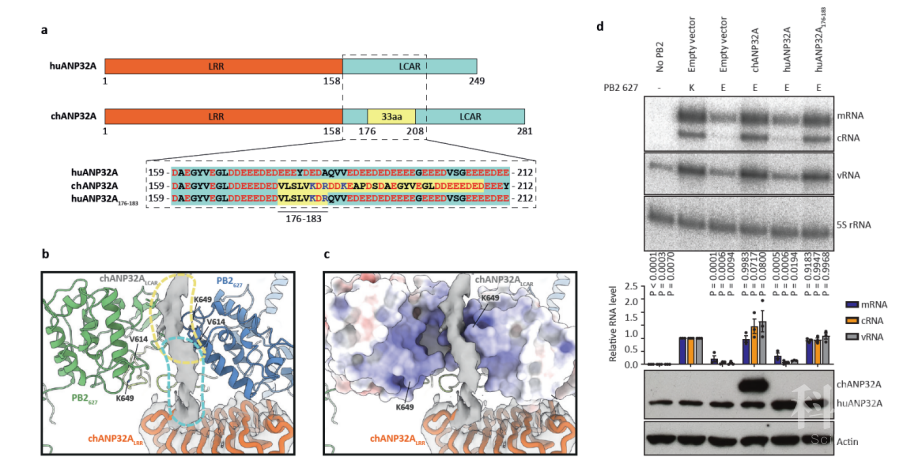
图4:流感病毒跨种传播机理。a, 人源(hu)和鸡源(ch)的ANP32A蛋白序列简图;b-c, 鸡源ANP32A蛋白的插入序列能够与PB2亚基627位残基(在C型流感中是649位)相互作用;d, 将鸡源ANP32A的相关序列替代人源ANP32A蛋白,该蛋白即获得了支持禽流感病毒活性的功能。
综上所述,该首次展示了流感病毒RNA聚合酶与宿主因子ANP32A的复合物结构。通过与功能实验相结合,揭示了流感病毒基因复制的复制酶的组装,以及宿主-病毒间相互作用的机制。介入蛋白间相互作用的关键氨基酸残基可以作为抗病毒药物设计的潜在靶点。
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652509269&idx=2&sn=5ed20b7dd356f1580aa0cf3fe9f679b4
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

最新!2019年版流行性感冒诊疗方案来了,三张图读懂中医怎么治流感

评论:“坏兔子”病毒闹心,怎样才能将网络恶棍拦在门外
宇宙可能到处都是外星病毒,或成发现外星人首个迹象

病毒,不单单是“祸害”

流感病毒 疫苗的诞生

艾滋病疫苗为何“难产”?
《自然》发文:麻省理工学院发现海洋中一种未知病毒

我国首个P4实验室正式运行,致力于最危险病毒研究
防疫 | 西班牙大流感的爆发和流感病毒的分类
新冠病毒和流感病毒有什么不同?