科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-11-19
来源:BioArt
人体中包含着数以万亿个微生物有机体,统称为共生微生物群【1】。随着DNA测序技术和生物信息学的进步,在过去的20年中,我们对微生物群的多样性和动态变化了解得越来越多。据估计,人体内的细菌细胞数量与人体细胞的数量大致相同,其中绝大部分(约1014种)定植在胃肠(gastrointestinal, GI)道中【2】。但目前对特定共生微生物与宿主相互作用的分子机制的了解还不够清楚。越来越多的研究表明,共生微生物在调节宿主生理系统方面发挥着重要的作用。因此,了解微生物如何与宿主相互作用不仅能够填补生物学上的空白,也对人类疾病潜在的治疗靶点提供了一个平台。
微生物能够调节宿主免疫系统的机制之一是通过调节细胞因子信号传导。I型干扰素(IFN-Is)是一类结构相似的细胞因子家族,主要由两类不同的蛋白组成,IFN-a和IFN-β,都通过共同的I型干扰素受体(IFNAR)形使功能【3】。IFN-I可以在所有有核细胞中经转录调控,高水平地被诱导出来以响应模式识别受体(PRRs)对病原体的感知【4】。随后通过诱导细胞抗病毒、凋亡等信号通路发挥关键作用。最近的研究表明,IFN-Is不仅仅只在感染过程中被诱导出来,也可以低水平地组成性表达,在维持稳态功能方面具有重要意义【5】,但该机制并未完全阐明。
2020年11月18日,哈佛医学院Dennis Kasper团队在Cell上在线了题为“Commensal Microbiota Modulation of Natural Resistance to Virus Infection”的研究论文,对未感染情况下共生微生物对IFN-I的调节作用进行了探索,发现共生微生物群可以通过诱导结肠固有层(lamina propria, LP)树突状细胞(dendritic cells, DCs)产生IFN-β来调节局部和全身的IFN-I反应,并阐述了特定共生微生物诱导IFN-β的分子机制。 研究人员首先分析不同小鼠组织在清除共生微生物后其下游干扰素刺激基因(ISG)的表达情况,发现最主要的共生微生物定植场所胃肠道、以及脾脏和淋巴结中的ISG表达均受影响,并利用IFN-β敲除小鼠模型证明了共生微生物通过IFN-β局部和全身性地调节IFN-I反应;随后,研究人员利用IFN-β-YFP报告基因小鼠发现IFN-β主要表达在结肠LP的DC上,并分离不同组织的DC后检测进行确认。利用IFN-β-YFP小鼠再次进行以上实验,研究人员确认了共生微生物可以诱导结肠LP的DCs中的IFN-β表达。
研究人员首先分析不同小鼠组织在清除共生微生物后其下游干扰素刺激基因(ISG)的表达情况,发现最主要的共生微生物定植场所胃肠道、以及脾脏和淋巴结中的ISG表达均受影响,并利用IFN-β敲除小鼠模型证明了共生微生物通过IFN-β局部和全身性地调节IFN-I反应;随后,研究人员利用IFN-β-YFP报告基因小鼠发现IFN-β主要表达在结肠LP的DC上,并分离不同组织的DC后检测进行确认。利用IFN-β-YFP小鼠再次进行以上实验,研究人员确认了共生微生物可以诱导结肠LP的DCs中的IFN-β表达。
接着,研究人员选取了肠道中常见的、已被证明具有免疫调节作用的、属于共生菌Bacteroidetes类的共生菌B.fragilis,来研究其是否会调节结肠LP的DCs中IFN-β的表达以及IFN-I的反应。4周龄的GF小鼠在定殖B.fragilis菌株NCTC 9343又两周后,分离结肠LP的DCs进行分析检测,结果显示B.fragilis定殖可以增强结肠(而不是小肠)LP的DCs中IFN-β的表达。随后又通过体外外膜处理骨髓衍生的树突状DCs(BMDCs)和体内荚膜多糖A(PSA)处理,证明了是B.fragilis的PSA组分显著诱导了结肠LP的DCs中IFN-β的表达。
由于PSA已被报道可以激活TLR2和dectin-1通路,研究人员进一步利用TLR2和dectin-1以及TLR4敲除小鼠等检测了PSA诱导IFN-β过程中的关键通路,得到结论,B.fragilis PSA的脂寡糖(Lipooligosaccharide, LOS)组分通过TRIF和Myd88依赖的TLR4信号通路诱导IFN-β的产生,并且这种诱导作用在Bacteroides sp.中是广谱性的。最后,研究人员利用同窝出生的VSV感染的Ifnb1-/-小鼠模型以及Tlr4-/-小鼠,分别证明了共生菌诱导的IFN-β可以在小鼠中增强抗VSV的感染能力,以及该过程依赖于B.fragilis PSA组分的抗病毒活性。
总的来说,本研究证明了共生微生物通过诱导结肠DCs的IFN-β来调节IFN-I反应,并阐述了相关机制,即Bacteroides fragilis及其荚膜相关的抗病毒活性分子多糖A(PSA),通过TLR4-TRIF信号诱导了IFN-β的产生,对VSV或流感感染具有一定的抵抗力。该研究表明诱导IFN-β的微生物分子可能是一种治疗某些人类疾病的潜在方法。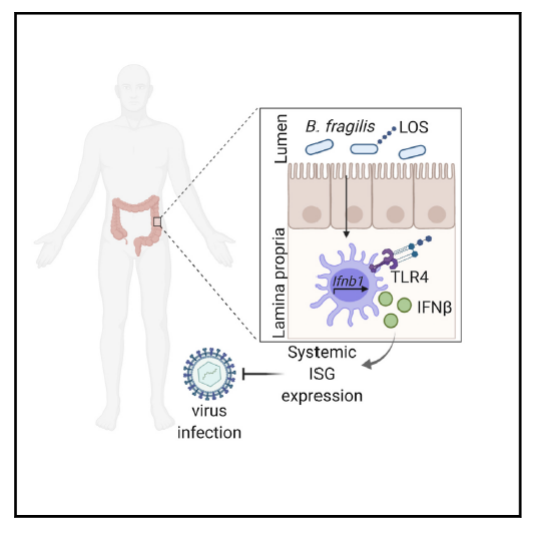 共生微生物通过IFN-β调控抗病毒感染
共生微生物通过IFN-β调控抗病毒感染
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652509269&idx=5&sn=c58827ea294f11ca756d0d147f3880f9
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
Science:自然选择怎样影响有机体的适应能力和进化
海绵共生微生物群落



中国两年要花三千万元,深挖微生物"黑科技"
微生物所发表中国微生物组数据平台

我国最大乳酸菌种资源库建成
科普:夫妻相真的与细菌有关吗?



疾病: 了解风湿性关节炎的发病机制
微生物学: 生命早期的抗生素使用可能会影响发育
口腔微生物会破坏阴道微生物平衡
细胞如何形成完整的有机体?单细胞测序技术揭秘