科技工作者之家
科界APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-05-16
来源:BioArt
由于先天性遗传因素,或者噪声、衰老、服用抗生素或化疗等后天因素,造成全球有接近1%人口患有残疾性听力损失,但是临床上缺乏有效的治疗方案,导致听力疾病将伴随患者终生。听力损伤的主要原因是内耳听毛细胞的退化或者死亡,但是在人类等哺乳动物中听毛细胞不能再生。斑马鱼侧线毛细胞与内耳听毛细胞在发育、结构和功能上非常类似,不同的是侧线毛细胞具有很强的再生能力,因而斑马鱼侧线系统成为研究听毛细胞再生的理想模型。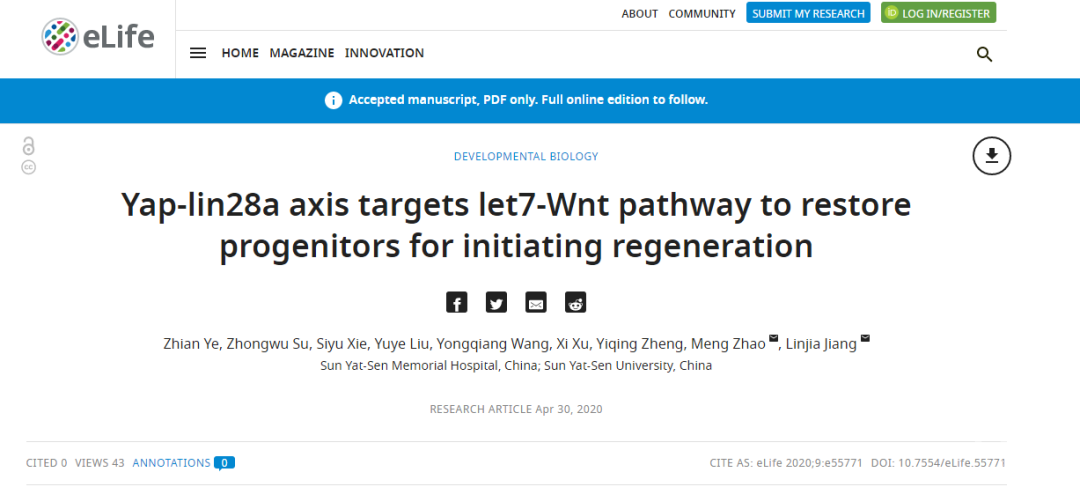
参考文献
1.Zheng, F., and Zuo, J. (2017) Cochlear hair cell regeneration after noise-induced hearing loss: Does regeneration follow development? Hear Res 349, 182-196
2.Castillo-Azofeifa, D., Fazio, E. N., Nattiv, R., Good, H. J., Wald, T., Pest, M. A., de Sauvage, F. J., Klein, O. D., and Asfaha, S. (2019) Atoh1(+) secretory progenitors possess renewal capacity independent of Lgr5(+) cells during colonic regeneration. EMBO J 38
3.Tomic, G., Morrissey, E., Kozar, S., Ben-Moshe, S., Hoyle, A., Azzarelli, R., Kemp, R., Chilamakuri, C. S. R., Itzkovitz, S., Philpott, A., and Winton, D. J. (2018) Phospho-regulation of ATOH1 Is Required for Plasticity of Secretory Progenitors and Tissue Regeneration. Cell Stem Cell 23, 436-443 e437
4.Lin, B., Srikanth, P., Castle, A. C., Nigwekar, S., Malhotra, R., Galloway, J. L., Sykes, D. B., and Rajagopal, J. (2018) Modulating Cell Fate as a Therapeutic Strategy. Cell Stem Cell 23, 329-341
来源:BioGossip BioArt
原文链接:https://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652484951&idx=7&sn=11640deb5a1d87f83e0c2c8a4f0417f0&chksm=84e226e3b395aff532b7bfe7696b68555077a7ac88c97aaf023493b110d4bc2adceb56e7b1fb#rd
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
人体长期以来被忽略的“器官”——间质被重新发现
【纳米】压电纳米结构诱导干细胞神经分化

R-spondin/LGRs调控人多能干细胞造血分化新功能
广州生物院揭示神经干细胞分化新机制
干细胞: 向不同心脏细胞类型的分化

“基因剪刀”首次让皮肤细胞变身干细胞
人类干细胞多谱系分化和重编程的多维表观遗传图谱
研究发现人多能干细胞肝向分化的关键调控因子
中国科协发布2016年度“中国生命科学领域十大进展”
分子细胞卓越中心等建立基于人内胚层干细胞的规模化肝向分化系统