科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-06-02
来源:BioArt
G蛋白偶联受体(G protein Coupled Receptor)是一类具有七次跨膜结构的膜受体蛋白,能够感知胞外如激素、神经递质、趋化因子、气味分子等多种类型的信号,并调节细胞内的生理生化反应。GPCR也是关键的药物靶标,目前FDA批准的药物中有超过30%是靶向GPCR的。肾上腺素受体是一类A型亚家族的GPCR,在交感神经系统中发挥着重要功能。在人体内,肾上腺素受体有9个亚型,它们彼此之间的序列和结构较为保守。传统对于GPCR的药物研发主要是针对正构结合位点(即受体的内源配体结合的位置),该位点在不同亚型之间的高度保守给研发选择性药物带来了很大挑战。别构调节剂结合在受体的正构配体口袋以外,由于其结合位置保守性相对较低,可能具有更好的亚型选择性。别构调节剂的发现为获得具有高选择性的药物提供了新的思路。清华大学结构生物学高精尖创新中心、清华大学医学院Brian Kobilka教授课题组的刘翔宇博士于2017年8月和2019年6月份先后在Nature和Science杂志发文报道了β2肾上腺素受体结合别构阻滞剂Cmpd-15【1】,以及结合别构激活剂Cmpd-6【2】的复合结构。
2020年6月1日,Brian Kobilka教授与清华大学药学院刘翔宇博士及其合作研究组在Nature Chemical Biology杂志在线发表了题为An allosteric modulator binds to a conformational hub in the β2 adrenergic receptor(结合在β2肾上腺素受体构象变化中心的别构调节剂)的文章。报道了结合在β2肾上腺素受体跨膜螺旋区面向细胞膜一侧的别构调节剂——AS408(是第三个被报道的β2肾上腺素受体的别构调节物),并解析了该配体与β2肾上腺素受体,以及正构拮抗剂阿普洛尔(Alprenolol)的复合物晶体结构,阐述了AS408作为结合在受体构象变化中心附近的别构拮抗剂发挥作用的机制,对于指导β2肾上腺素受体别构药物的研发具有重要意义。

考虑到β肾上腺素受体的别构调节剂在治疗高血压,哮喘以及心脏疾病在内的多种复杂疾病的潜力,研究人员通过虚拟筛选与优化的方式得到了一个新的β2肾上腺素受体的别构拮抗剂AS408,并通过一系列生理生化实验验证了其功能。Brian Kobilka教授课题组希望通过X-射线晶体学的手段了解AS408作为β2肾上腺素受体别构拮抗剂的结构基础。研究人员利用β2肾上腺素受体和T4溶菌酶的融合蛋白(β2AR-T4L)对AS408与受体的正构拮抗剂阿普洛尔共结晶,获得了3.1埃的晶体结构(图1A)。有趣的是,研究人员初期进行虚拟筛选的目标口袋是位于受体正构结合位点上方的外部口袋,而从晶体结构中研究人员发现AS408结合在受体跨膜螺旋3,5胞内段与细胞膜之间的位置(图1B),靠近受体的构象变化中心。
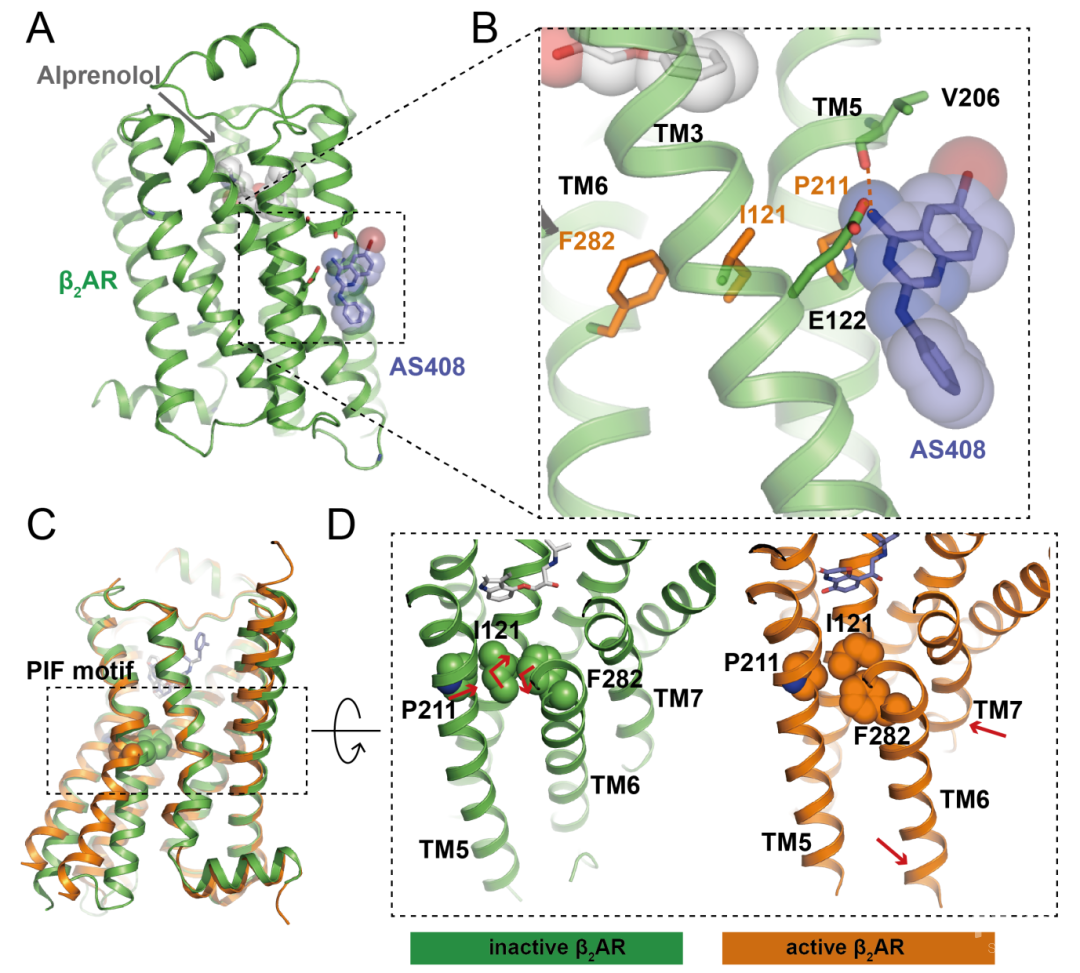
图1:别构拮抗剂AS408结合在β2肾上腺素受体的构象变化中心PIF基序附近。A:β2肾上腺素受体结合正构拮抗剂阿普洛尔(Alprenolol)和别构拮抗剂AS408复合物的晶体结构。B:AS408的结合位点在PIF基序(P211,I121和F282三个氨基酸)附近。C:β2肾上腺素受体激活状态(橙色)和非激活状态(绿色)的比较。D:PIF基序是β2肾上腺素受体的激活过程中的构象变化中心,其构象变化引起了TM6胞内区的外移和TM7胞内区的内移。
研究人员通过结构分析,分子动力学模拟以及生理生化实验的方法研究了AS408在别构位点影响β2肾上腺素受体功能的机制。结果表明,AS408结合位点靠近一个在A家族GPCR中十分重要的构象变化中心——PIF结构基序,该基序的构象变化是导致受体第6跨膜螺旋向外摆动的重要因素,而后者被认为是GPCR被激活的标志(图1C-D)。因此,AS408的存在限制了PIF基序的构象变化,使受体更倾向于稳定在非激活状态,抑制了受体对G蛋白的偶联或者对arrestin蛋白的招募。此外,研究人员还发现AS408不仅能够抑制激动剂与受体的结合,还能够增强反向激动剂,如ICI-118,511对受体的亲和力。考虑到PIF基序在A家族GPCR内的高度保守性,AS408的发现对于指导其他类型GPCR在相似位置处开发新的别构调节剂具有十分重要的意义。参考文献
1. Liu, X., Ahn, S., Kahsai, A.W., Meng, K.C., Latorraca, N.R., Pani, B., Venkatakrishnan, A.J., Masoudi, A., Weis, W.I., Dror, R.O., et al. (2017). Mechanism of intracellular allosteric beta2AR antagonist revealed by X-ray crystal structure. Nature 548, 480-484.2. Liu, X., Masoudi, A., Kahsai, A.W., Huang, L.Y., Pani, B., Staus, D.P., Shim, P.J., Hirata, K., Simhal, R.K., Schwalb, A.M., et al. (2019). Mechanism of beta2AR regulation by an intracellular positive allosteric modulator. Science 364, 1283-1287.
来源:BioGossip BioArt
原文链接:https://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652486614&idx=6&sn=d1984d5a317ffa3fc7c317e7e83e0599&chksm=84e22862b395a174bf76473f63e05fe81c6ff5205295b5129c551d48912515e271256e88973e#rd
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
《细胞》发文!阿片类药物迎来重大突破
首次解析α2B肾上腺素受体分别结合Gi和Go蛋白复合物高分辨率三维结构
尿液去甲肾上腺素
中科院等科学家合作研究揭示中枢去甲肾上腺素能神经元发育调控新机制

人体细胞内存在“铁路”系统,能自动优化结构
DL-脱氧肾上腺素

天价冬虫夏草能否抗癌成“罗生门”
DL-去甲肾上腺素
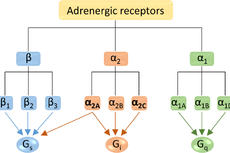
钟桂生/赵素文/武栋合作团队阐释肾上腺素受体多样性和配体特异性的机理
从健康细胞到癌细胞,或许只需要几个突变