科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-06-03
来源:CBG资讯
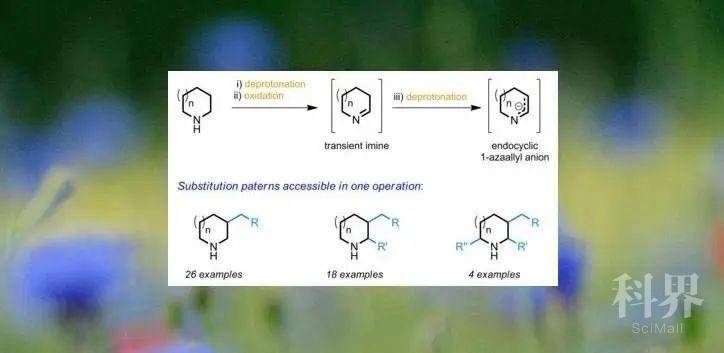
将脂环胺中不活泼的C-H键直接转化为C-C或C-X键,是对天然产物和药物分子中普遍存在的杂环结构进行官能团化的理想方法。环胺的α-C-H键官能团化已取得相当大的进步,但是大多数方法不兼容胺N-H键,因此需要引入保护基团,这通常会对下一步转化产生阻碍。环胺上更远位置上的C-H键的官能团化方法仅限于叔胺、N-芳基或N-酰基胺,而同对环胺环上的多个位置进行官能团化是非常少的。直接形成仲胺产物,以及在一次操作中同时对环胺环上三个位点进行官能团化还都没有报道。
最近,美国佛罗里达大学Daniel Seidel课题组发展了在不需要保护基或过渡金属的情况下,对脂环仲胺的β-C-H键区进行域选择性官能团化的策略,并在一次操作下最多可在环上引入三个取代基,其成果发表在Nature Chemistry(DOI: 10.1038/s41557-020-0438-z)。
现有的脂环胺及其衍生物的β-C-H键官能化方法可通过不同的反应途径来实现(Fig. 1a-1e),通常需要引入导向基团,并且在金属催化下还会产生一定比例的α-芳基化产物。受Wittig和Hesse关于N-锂化胺的开创性工作的启发,N-锂化的吡咯烷与不可烯化的亚胺反应,可实现β-C-H官能团化和芳构化(Fig. 1f)。作者最近开发了一种对未保护脂环胺的直接α-C-H键官能团化的方法(Fig. 1g)。有机金属亲核试剂加成到由N-锂化胺1和简单酮氧化剂原位生成的环状亚胺1-哌啶2上,这一策略也可能促使β-C-H的官能团化(Fig. 1h)。具体地说,设想2的去质子化生成环内1-氮杂烯丙基阴离子4。然后,1-氮杂烯丙基阴离子可以与烷基化试剂结合,从而形成新的亚胺5。5经还原后处理生成β-官能团化的胺6。此外,亚胺5与亲核试剂反应生成的中间体锂7也能进一步生成α,β-双官能团化的胺8(Fig. 1i)。最后,同样以这一思路就可以通过一次操作来制备α,β,α'-三官能团化的脂环胺(Fig. 1j)。实现这些取代方式取决于首先生成内环1-氮杂烯丙基阴离子4的能力。作者认为最主要的是锂化脂环胺和酮原位生成单体内环亚胺要与加入适当的碱所发生的去质子反应相兼容。
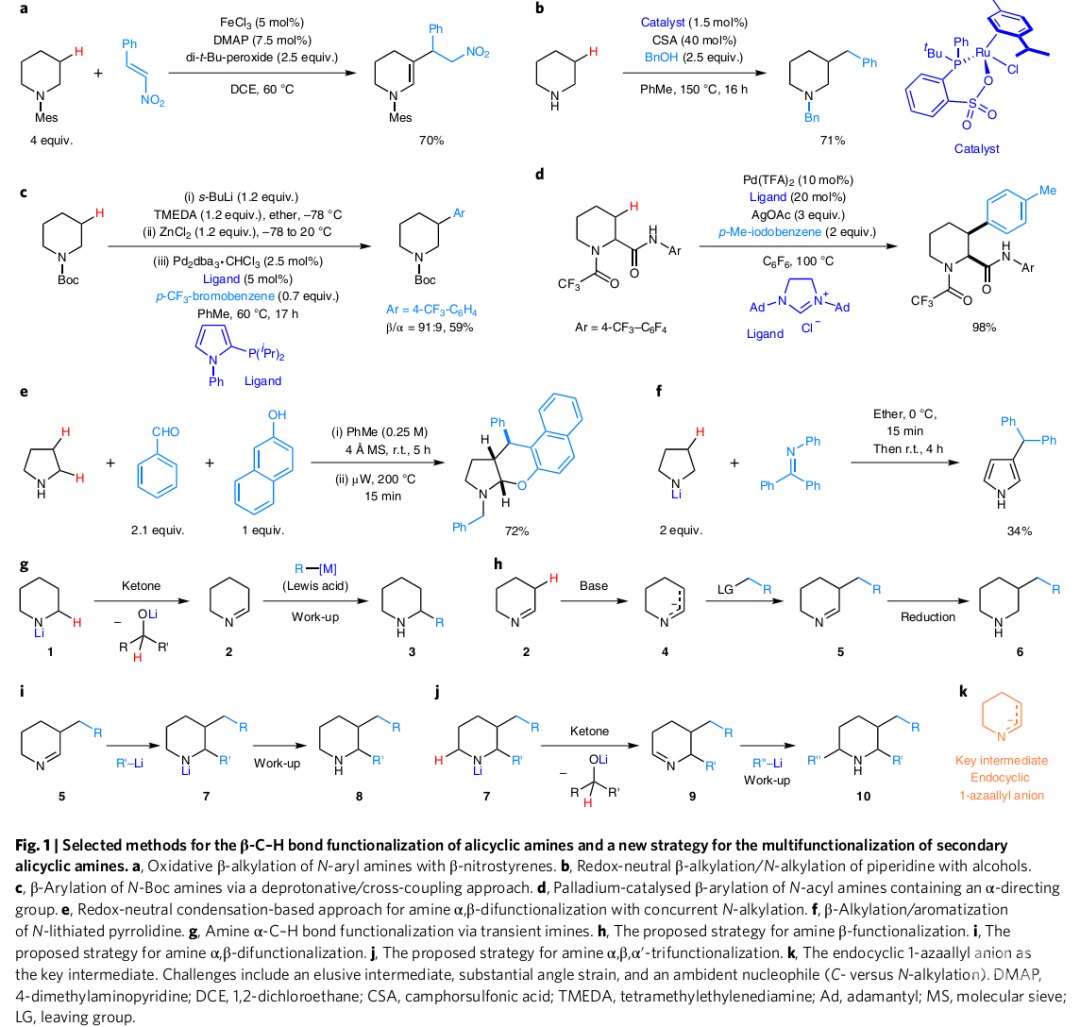
(图片来源:Nature Chemistry)
为避免不良的竞争性反应和N-烷基化反应,经过大量的实验和优化,作者确定了简单的反应步骤将脂环仲胺的相应的母体杂环有效地进行β-官能团化(Table 1)。单体环状亚胺由N-锂化胺和三氟苯乙酮原位制备,随后与二异丙基氨基锂(LDA)发生去质子化形成内环1-氮杂烯丙基阴离子,该阴离子可以与各种苄基、烯丙基和烷基卤反应。接着,使用硼氢化钠将中间体亚胺还原,通常以良好的产率获得β-取代胺。
尽管N-Boc保护不是绝对必须的,但对大多数胺进行了保护之后可以促进产物分离。作者发现高分子量的(±)-11y和(±)-11z属于相对非极性产物,两者含有游离氨基,很容易分离。对于大规模反应,如多极性胺(±)-11f的合成,可以很容易通过蒸馏将其分离提纯,得到游离碱形式的产物。(±)-11f 为CCR3拮抗剂的核心结构,以前至少需要五个步骤才能合成其外消旋形式。胺β-烷基化与一系列官能团相容,包括卤化物、腈、酯、醚、烯烃和不同的杂环。各种大小的环状烷基胺也很都可以顺利地完成β-官能团化。在C4位上存在的取代基的哌啶产物具有优异的非对映选择性。2-甲基-哌啶以良好的产率完成了区域选择性β'-苄基化生成(±)-12u。
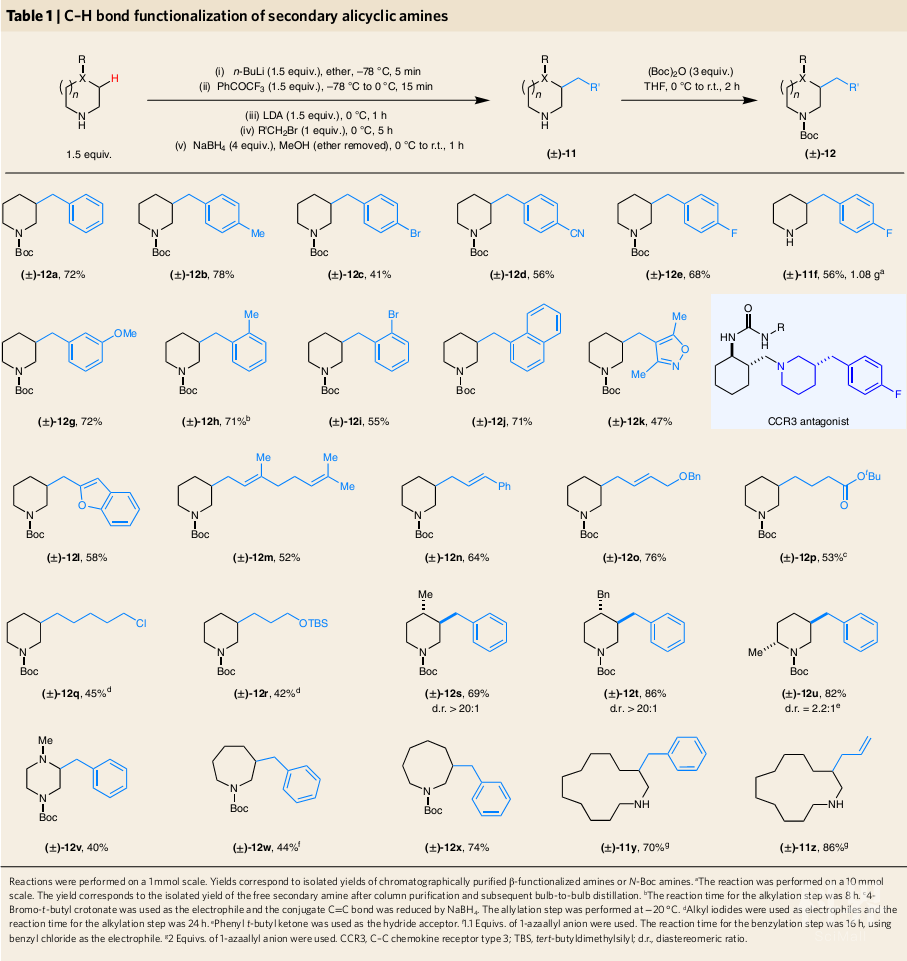
(图片来源:Nature Chemistry)
作者对反应程序进行简单的修改,即通过添加有机锂亲核试剂来代替NaBH4还原步骤,可以制备范围广泛的α,β-双官能团化脂环仲胺(Table 2)。这类反应在许多情况下均有良好的非对映选择性。除(±)-13n外,所有产物非对映异构体都易于分离。α,β-双官团能化仲胺产物是重要的有机骨架,可进一步转化为各种其他结构的化合物,例如,(±)-13r可很容易地转化为双环叔胺(±)-14。
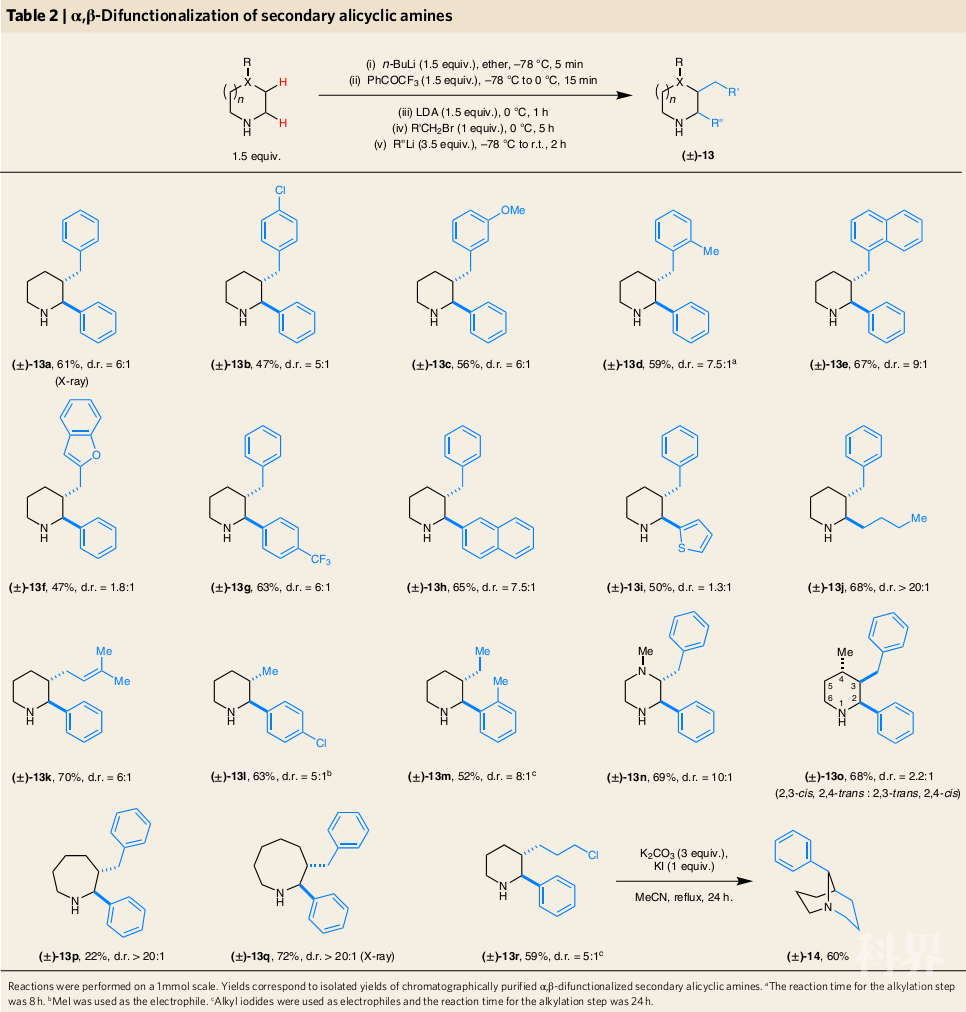
(图片来源:Nature Chemistry)
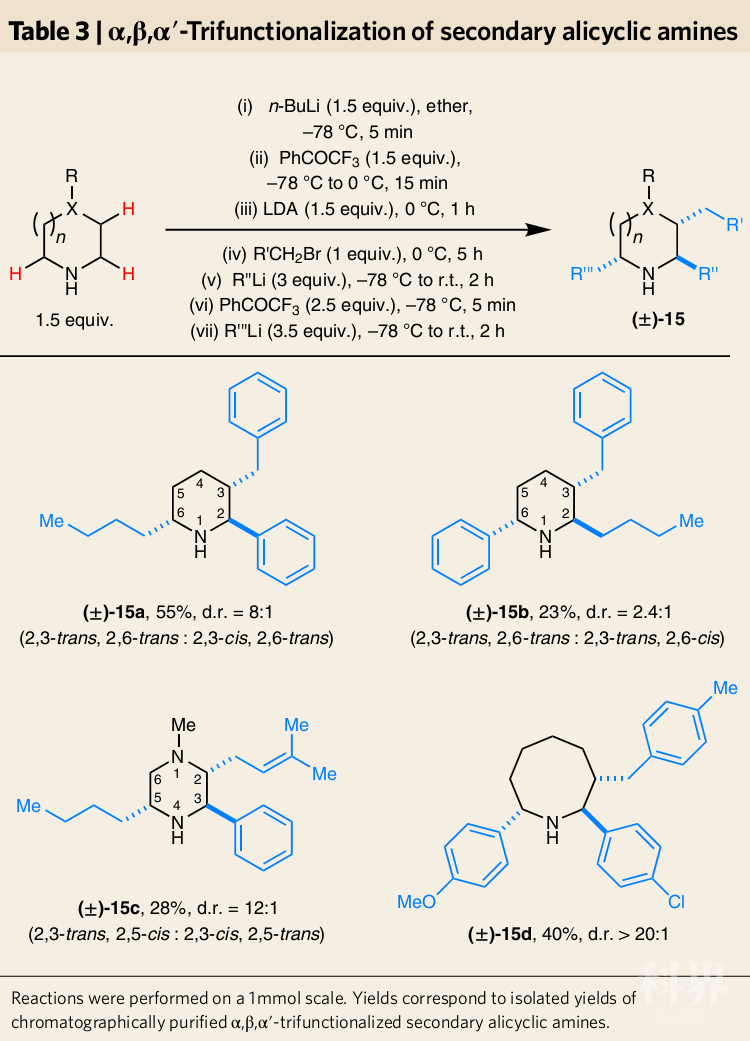
另外,作者也前所未有地实现了在一次操作下获得环上三个不同位置官能团化的产物(Table 3),进一步证明了该方法对实现脂环仲胺C-H键官能团化的能力和优势。将N-锂化的(±)-13a中间体暴露于三氟乙酰丙酮中,然后加入正丁基锂,可有效合成具有三个不同取代基的α,β,α'-三官能团化的胺(±)-15a。取代基的位置只需更改加料顺序即可随意更改,可通过更改顺序合成(±)-15a的结构异构体(±)-15b。作者还用N-甲基哌嗪和氮杂环辛烷成功进行了类似的转换,分别生成相应的三官能团化产物(±)-15c和(±)-15d。虽然胺的C-H三官能团化产物的产率较低,但是这一方法可以应用在相关药物合成中。
(图片来源:Nature Chemistry)
小结:作者利用原位生成的环状1-氮杂烯丙基阴离子作为关键中间体,开发了脂环仲胺β位和多个C-H键官能团化的方法。并且,与大多数使单个C-H键官能团化的方法相反,此方法不需要保护基或过渡金属。
来源:BeanGoNews CBG资讯
原文链接:https://mp.weixin.qq.com/s?__biz=MzI4ODQ0NjUwMg==&mid=2247502344&idx=2&sn=26d042f8530219f0c1739491edd2da21&chksm=ec3ccb41db4b4257eb3642f0bcfe7c0e3de0b9448ab0e5af50b4167c4d843498c6619fe4fabe#rd
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

今年热怕了?Nature子刊:别急,未来4年可能更热

Nature:肿瘤代谢产物阻碍DNA修复!原因在于局部染色体信号扰乱!
Nature :研究发现肠道微生物来源的代谢产物可促进HDAC3活性
电解产物

我学者在光调控催化N-烷基化反应中取得新进展
激活产物

Nature | 胆汁酸次级代谢产物促进结肠组织Treg细胞产生
华侨大学博士生首次在Nature发文



聚合物官能度

铁催化氧化吲哚-2-酮与烷基取代N-杂芳烃的直接烷基化和羟基化反应