科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-06-04
来源:BioArt
正常细胞代谢所需的能量主要由线粒体氧化磷酸化产生的ATP提供,而肿瘤细胞即便氧供充足也偏好利用糖酵解供能。肿瘤细胞的糖酵解代谢为其提供充足的ATP,利于其生长增殖。近年来,针对肿瘤细胞能量代谢的研究受到广泛关注,基于肿瘤能量代谢的内在分子机制研究,将对肿瘤治疗提供新的指导方向。N6-甲基腺嘌呤(m6A)mRNA修饰在细胞的生物学功能具有多种调控作用。研究发现肿瘤细胞的m6A修饰调控肿瘤的生长、增殖及转移,然而m6A修饰是否参与肿瘤细胞的能量代谢中尚待深入研究。
近日,中山大学药学院王红胜课题组在Nature Communications期刊上发表题为 N6-methyladenosine regulates glycolysis of cancer cells through PDK4 的研究论文,发现RNA的m6A修饰对肿瘤细胞的能量代谢有积极调节作用,其可通过丙酮酸脱氢酶激酶4(PDK4)参与肿瘤细胞的糖酵解和ATP生成。

本研究发现,m6A修饰参与肿瘤细胞的糖酵解和ATP生成。甲基转移酶METTL3的缺失使得m6A水平下调,并抑制肿瘤细胞的葡萄糖摄入、乳酸产生速率和ATP生成。m6A-seq和功能实验表明,PDK4的表达受m6A调控,且过表达PDK4能逆转METTL3缺失导致的肿瘤细胞糖酵解和ATP生成抑制。进一步研究表明,PDK4 mRNA的5’UTR区而非3’UTR区的m6A修饰,可通过与YTHDF1/eEF-2复合物和IGF2BP3结合,从而正向调节其mRNA的翻译延伸及mRNA稳定性。此外,TATA结合蛋白(TBP)可以通过与METTL3启动子结合增强其转录及在宫颈癌细胞中的表达。体内和临床分析表明,m6A/PDK4在宫颈癌和肝癌组织表达上调,且对其发生发展具有促进作用。
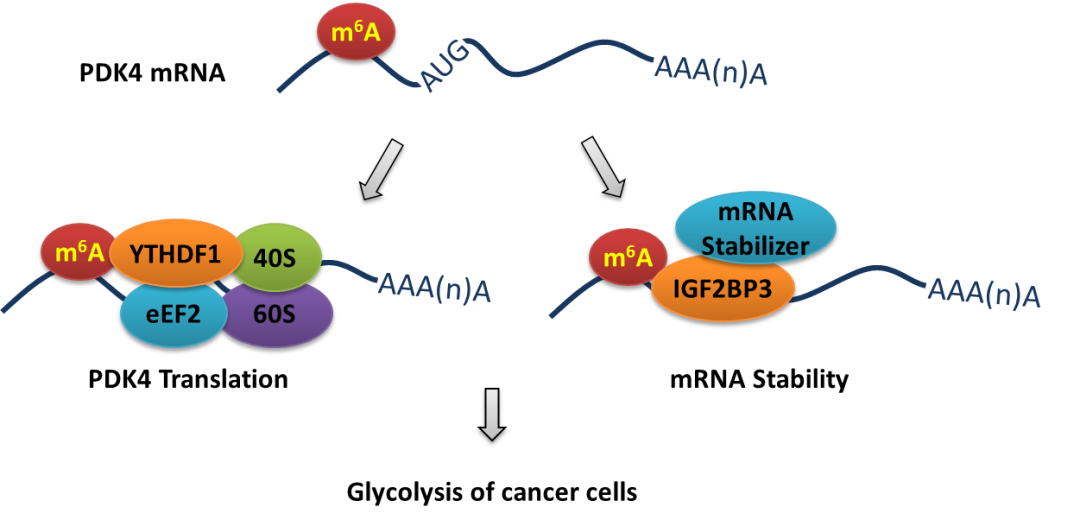
图 m6A调控PDK4翻译及mRNA稳定性介导肿瘤细胞糖酵解示意图
此外,中山大学药学院王红胜课题组还在Nucleic Acids Research期刊上发表题为Targeted mRNA demethylation using an engineered dCas13b-ALKBH5 fusion protein 的研究论文,成功构建基于dCas13b-ALKBH5的融合蛋白体系dm6ACRISPR,实现在活细胞内靶向mRNA进行去甲基化修饰。同时,在肿瘤细胞中运用dm6ACRISPR靶向促癌基因EGFR和MYC,可显著降低其表达和抑制肿瘤细胞的生长


RNA甲基化修饰约占所有RNA修饰的60%以上,而N6-甲基腺嘌呤(N6-methyladenosine, m6A)是高等生物mRNA中最为普遍的转录后修饰。m6A修饰由“编码器(Writer)”、“消码器(Eraser)”和“读码器(Reader)”共同调控其动态变化。其中,FTO和ALKBH5是目前已知的去甲基化酶,可“擦除”mRNA上的m6A修饰。m6A修饰对细胞各生物学行为具有多种调控作用,然而在活细胞内探讨m6A修饰在靶mRNA上的具体作用尚未能实现。近年来基于CRISPR/Cas体系发展而来的基因编辑技术发展迅速,其中,酶失活型DNA结合酶dCas9联合功能蛋白所构建的融合蛋白体系可在活细胞内定向改造DNA的表观遗传修饰。与Cas9功能相似,Cas13b可结合并剪切RNA,而酶失活型Cas13b(dCas13b)联合gRNA可在活细胞内结合靶mRNA,使活细胞内的mRNA表观遗传修饰编辑变成可能。
本研究利用dCas13b融合去甲基化酶ALKBH5,结合靶向mRNA的gRNA,构建出可在活细胞内靶向mRNA的m6A去甲基化修饰体系dm6ACRISPR。该体系具有特异性强、去甲基化效率高和脱靶率低等特点。研究表明,dm6ACRISPR可实现CYB5A mRNA的单位点及CTNNB1 mRNA的多位点去甲基化,提高靶mRNA稳定性。同时,dm6ACRISPR具有高度错配不耐受的特点,其细胞内脱靶率仅为0.03%。此外,在肿瘤细胞中运用dm6ACRISPR体系靶向促癌基因EGFR和MYC,可显著降低其表达水平,同时明显抑制肿瘤细胞生长,表明dm6ACRISPR在疾病防治上具有潜在价值。

图 dm6ACRISPR去甲基化编辑示意图
上述研究工作获得中山大学第一附属医院林水宾研究员课题组和德州大学西南医学中心江正明教授课题组的帮助。
来源:BioGossip BioArt
原文链接:https://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652486934&idx=7&sn=76935d3285a34ab5681f316fba730aac&chksm=84e22ea2b395a7b42b3322a58b59f6007501c2d53ef4166669c047bb946d661f0eae9309a084#rd
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
【人物聚焦】中国细胞生物学奠基人——郑国锠
停课不停学 《医学细胞生物学》变身线上精品课



2017年全国植物细胞生物学大会顺利召开




中国细胞生物学学会-细胞治疗研究与应用分会第一届年会
水生所蓝藻细胞生物学研究获进展
中国细胞生物学学会/上海市创新细胞生物学发展基金会2022年资助项目公示
辽宁省细胞生物学学会医用高分子与细胞生物学专业委员会首届学术会议在沈阳召开

国际细胞生物学研究热点,你get到了吗?
靶向能量代谢的抗肿瘤金属配合物

中国细胞生物学学会第六期细胞黄浦研修班举办