科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-06-05
来源:BioArt
骨骼肌干细胞(Skeletal Muscle stem cells),简称肌肉干细胞(muscle stem cells), 又称卫星细胞(satellite cells),其主要功能是负责对骨骼肌进行损伤修复。肌肉干细胞对肌肉发育和组织再生至关重要。在健康的骨骼肌中,肌肉干细胞处在‘休眠期‘(quiescence)。而当骨骼肌受到损伤时, 肌肉干细胞会被激活,然后增殖,分化成肌细胞进而修复受损的组织。休眠期的调控(quiescence maintenance)对干细胞的功能非常重要。拿肌肉干细胞举例,一方面,肌肉干细胞需要有快速离开休眠期(quiescence exit)的能力。当肌肉组织受到损伤时,肌肉干细胞需要迅速感应到所处环境(niche)的变化, 离开休眠期,激活,进入细胞周期,去产生更多的肌肉细胞从而修复组织。另一方面,如果肌肉干细胞休眠期失调,肌肉干细胞就会在骨骼肌健康的条件下提前离开休眠期,增殖分化,进而导致干细胞池的耗竭(stem cell pool depletion)。干细胞池耗竭的后果就是,一旦组织受到损伤,组织就会因缺少足够的干细胞而难以修复,最终导致组织功能的受损甚至丧失。因此,研究者一直都致力于研究干细胞是如何聪明地,精准地,去把握这种休眠期的平衡。另外,通过了解干细胞休眠期的调控机制,研究人员可以更好地利用干细胞,进行临床组织再生应用。
2020年6月4日,香港科技大学生命科学部张晓东教授实验组(Dr. Tom Cheung Group, Hong Kong University of Science and Technology)在Developmental Cell 在线发表了题为"Dek Modulates Global Intron Retention during Muscle Stem Cell Quiescence Exit’"的研究论文,发现Dek可通过调控干细胞的内含子保留影响干细胞的休眠和激活。
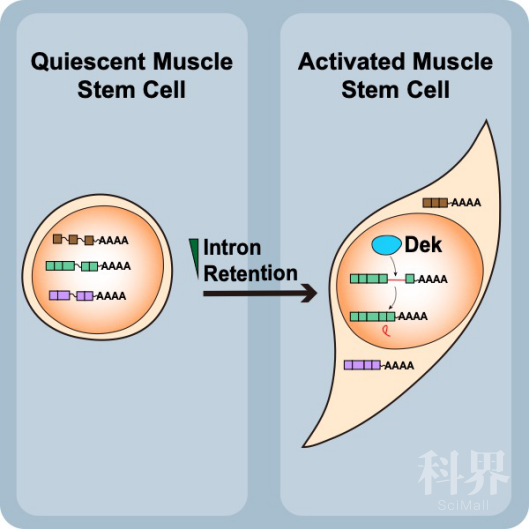
张晓东教授为该论文的通讯作者。岳麓(博士生)和负责生物信息分析的Raymond Wan (博后)为该论文的共同第一作者。
来源:BioGossip BioArt
原文链接:https://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652487096&idx=6&sn=f7f70986beaf9a68afa1960ba6899f97&chksm=84e22e0cb395a71a23b5efd22092f59b33f20fc086fc42950d5b3c55958ac49d1946440f102c#rd
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
神经干细胞

DNA合成+干细胞工程,新技术可构建细胞发育指导基因
细胞通讯决定腺体干细胞命运

“基因剪刀”首次让皮肤细胞变身干细胞

干细胞研究

上海交大王传德课题组发文揭示RPD1蛋白介导线粒体内含子剪接的分子机制
自体血清干细胞

中国科学家首次破译细胞“返老还童”二维码
打破认知,核糖体蛋白参与植物细胞器内含子剪切

3D迷你大脑,助力脑功能修复研究