科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-06-05
来源:CBG资讯
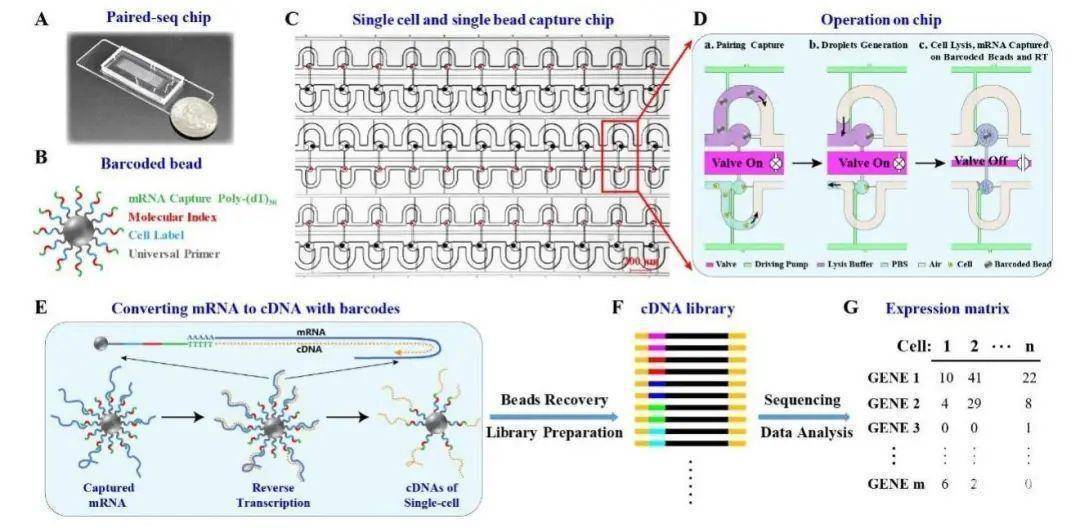
厦门大学杨朝勇教授课题组在高通量单细胞转录组测序新器件新方法研究方面取得重要进展,相关研究以“Highly parallel and efficient single cell mRNA sequencing withpaired picoliter chambers”为题发表于Nature Communications(Nat.Commun.,2020,DOI:10.1038/s41467-020-15765-0)。
单细胞转录组测序技术在单个细胞水平上对转录组进行高通量测序分析,从而揭示单个细胞内所有基因的表达情况,揭示细胞间的异质性,在发育生物学、免疫学、微生物学、神经科学、临床医学等领域有重要的应用前景。单细胞转录组测序的挑战在于如何高效地操控单个细胞,如何对大量的低拷贝数mRNA进行无偏倚扩增,如何避免背景游离mRNA的污染,以及如何同时对大量的单细胞进行并行测序以降低成本。
针对上述挑战,杨朝勇教授课题组开发了一种全新的高通量单细胞转录组测序新方法(Paired-seq)。Paired-seq通过将高效单细胞捕获操控微流控芯片与DNA编码微珠技术相结合,一次测序即可完成对成百上千个单细胞转录组的同时分析,解决了单细胞转录组测序存在的关键难点。首先,该工作设计了一种基于差异流阻原理及微阀微泵控制的高效单细胞/单微珠捕获与操控的微流控芯片,可实现对痕量细胞样本的高效率单细胞捕获。其次,Paired-seq利用DNA编码技术,使每个细胞内的基因带上独一无二的细胞标签和分子标签,实现对大量单细胞同时操控测序,通过标签信息对不同细胞来源的信息进行区分,保证每个细胞转录组信息的独立性,同时通过分子标签对mRNA分子表达量进行数字化统计,从而消除了序列差异导致的扩增偏差。此外,该芯片集成了微阀微泵结构,实现微量反应体系的主动快速混合、交换以及对单细胞的清洗,提高了细胞的裂解效率并有效地清除了溶液中背景游离RNA,大大降低了游离RNA的污染。最后,皮升级单细胞反应腔体极大地提升了RNA分子的局部浓度,从而实现痕量RNA分子的高效捕获与反转录扩增,提高了方法的基因检测灵敏度。与其它单细胞测序平台相比,在相同的测序深度下,Paired-seq可以检测到更多的基因,极大地降低了测序成本。基于以上系列创新的设计,Paired-seq具有细胞利用率高、灵敏度高和测序成本低的优势,为单细胞的异质性研究提供了有力的分析工具。
该工作由厦门大学、上海交通大学、美国斯坦福大学等多团队联合攻关完成。化学生物学系博士研究生张明霞、邹远和2011协同创新中心博士研究生许醒为论文的共同第一作者。该研究工作得到国家重大科研仪器研制项目、国家基金委重点项目、创新研究群体项目等支持。
来源:BeanGoNews CBG资讯
原文链接:https://mp.weixin.qq.com/s?__biz=MzI4ODQ0NjUwMg==&mid=2247502509&idx=3&sn=c106fe0e56a477242b21047fbe304f06&chksm=ec3ccbe4db4b42f2fd154e498af62d2579bc2ab705cad73fdc4eca2a3940f0a4d963c665b6b7#rd
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

中国科学家成功实现活细胞转录组测序

血液转录组测序可提高罕见病的诊断率

植物适应高温胁迫研究领域取得重要进展!

刘峰课题组合作研究绘制造血干细胞扩增组织的3D转录组图谱

基因组学新工具——单细胞蛋白、转录组、克隆型和CRISPR扰动的多重检测

血液转录组测序可提高罕见病的诊断率

Science 文章:转录组测序揭示正常组织的体细胞克隆

Nanopore单细胞转录组测序来了!
田鲁亦等通过单细胞转录组测序发现新的淋系祖细胞

利用单细胞转录组测序“解码”自闭症和阿尔兹海默症