科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-06-25
来源:BioArt
撰文 | Lala
责编 | 雪月
大多数生命过程都需要线粒体产生能量。许多内部和外部因素会损害这些“微型发电站”,并可能导致细胞死亡。比如在患有帕金森病或阿尔茨海默病的患者中,神经元通常表现出线粒体损伤。目前不清楚线粒体损伤如何触发细胞的死亡,为了更好地了解此过程,需要研究线粒体损伤对活神经元的影响,但目前技术尚不能达到。
近日eLife在线发表美国匹兹堡大学Edward A Burton教授研究组的论文Chemoptogeneticablation of neuronal mitochondria in vivo with spatiotemporal precision and controllable severity 。研究人员设计了一种新的化学光遗传学工具,可以损伤活斑马鱼幼体神经元中的线粒体,并对其造成的伤害进行调控。

首先,研究人员对斑马鱼进行转基因改造,体内神经元中的线粒体携带荧光激活蛋白(FAP)dL5 **和荧光报告基因mCerulean3,以实现体内转基因表达的可视化。dL5**可以与化合物MG2I结合,并通过局部产生高破坏力的化学物质来响应远红光。
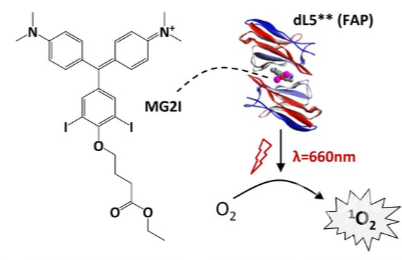
在NeuMitoFAP-MG2I斑马鱼中,远红光最初会导致短暂的运动亢进,随后是运动功能的逐渐丧失,在对照组中未观察到这些异常。尽管暴露于远红光下的NeuMitoFAP-MG2I斑马鱼丧失了自发和诱发性的运动功能,但它们的心率和循环得以保留,并且没有明显的形态变化,表明幼鱼仍然存活,并且损伤仅限于神经系统。此外,损伤的严重程度远红光能量决定。每当远红光照射到幼鱼上时,它们神经元中的线粒体就会受到伤害,光线越亮,伤害就越大。暴露于光线下约24小时后神经元开始死亡,这表明线粒体损伤引发了其他下游过程,最终导致细胞死亡。
电生理实验表明急性神经功能缺损是由神经元去极化引起的,添加磷酸肌酸可阻止这一过程的发生,表明去极化又是由ATP的耗竭引发的(磷酸肌酸是细胞质肌酸激酶的底物,可从ADP再生ATP,从而提供非线粒体ATP来源;维持细胞膜跨膜离子梯度的活性离子转运蛋白需要ATP的消耗)。
接下来,研究人员评估了NeuMitoFAP-MG2I斑马鱼中的线粒体功能。使用生物发光测定法测量ATP浓度显示,远红外线暴露导致斑马鱼的ATP含量降低约10%;使用流量分析仪分析线粒体呼吸以测量氧气消耗率(OCR),发现降低了约24%。综合数据表明MG2I和远红光的组合在NeuMitoFAP斑马鱼中引起线粒体功能丧失和呼吸功能的重大破坏。
除了评估线粒体功能,研究人员还通过活体显微镜检查线粒体形态,发现存在MG2I时,且远红外线曝光后,NeuMitoFAP斑马鱼轴突中圆形小线粒体数量增加了。与对照组比较表明,NeuMitoFAP、MG2I和远红光的组合引起轴突线粒体的碎片化。
在远红外光照射后,在斑马鱼的神经元中立即观察到严重且广泛分布的线粒体异常。然而,值得注意的是,尽管线粒体发生了巨大变化,但相邻的核膜、高尔基体和内质网在此时仍正常。暴露后2小时后开始显示核染色质浓缩和其他形态变化,包括核膜分离;暴露后24小后可见许多凋亡小体,表明细胞凋亡正在进行中,这些表明线粒体损伤导致神经元死亡延迟。
这种新型光控工具可以帮助了解线粒体损伤的后果,提供了研究帕金森病或阿尔茨海默病等神经退行性疾病受损神经元的新方法。将来该方法可能适用于在任何类型的细胞中工作,并使其他细胞器失活,并用于研究多种类型的疾病。
原文链接https://doi.org/10.7554/eLife.51845来源:BioGossip BioArt
原文链接:https://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652488934&idx=6&sn=8c4bf76d6f367aa06b6e7e136e59edb0&chksm=84e25752b395de4468c3f5343ebd8c76d0c8c67b288ff5ac3d336f96e11a3759070aa3365650#rd
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
研究发现饥饿抑制母性筑巢行为----中国科学院

光遗传学揭示大脑如何产生感知

Nat Methods重磅:无需光纤植入的“经颅光遗传学”来了!

中文解读 | 脑出血后铁毒性、脂质过氧化和铁死亡
Nature Medicine 重磅:光遗传学疗法能够重获光明

人类大脑有多少个神经元细胞
脑损伤激活胶质细胞产生神经元

《科学》:戒烟药还能控制大脑神经元?这一黑科技有望治疗多种神经疾病

北方是家鸡的驯化中心?线粒体DNA分析不支持
大脑“后勤”细胞参与指挥神经元发育