科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-07-04
来源:BioArt
责编 | 酶美
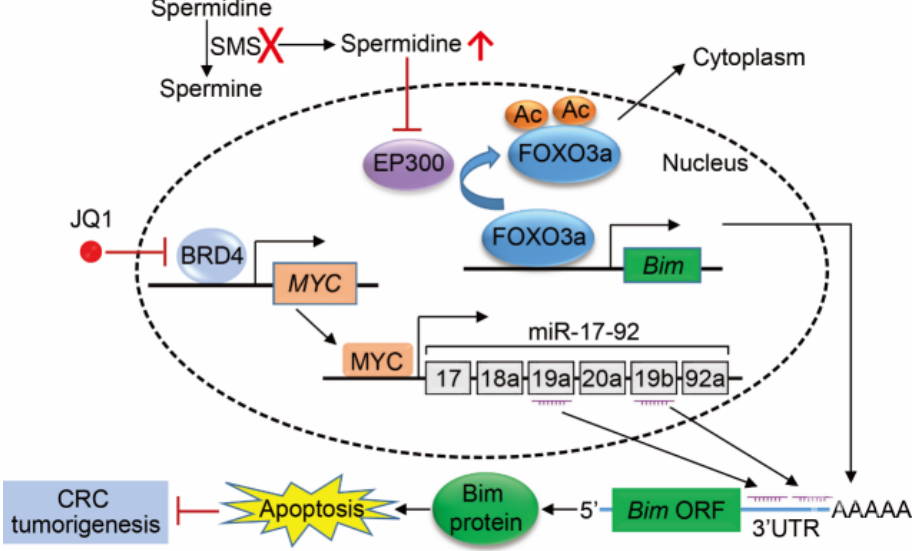
多胺是一类含有两个或更多氨基的小分子代谢产物,主要包括腐胺(PUT, Putrescine)、亚精胺(SPD, Spermidine)和精胺(SPM, Spermine)三种,在细胞生长中起着核心作用。鸟氨酸脱羧酶是多胺生物合成的一个关键酶,它能够将鸟氨酸催化生成PUT,PUT在亚精胺合成酶的作用下催化生成SPD,SPD在精胺合成酶(SMS, Spermine synthase)的作用下催化生成SPM。已有研究显示SPD对于细胞增殖和恶性转化具有重要的作用,但SPD在细胞中的过度积累反过来会对细胞生长产生重大的有害影响,那么,肿瘤细胞是通过什么调控机制维持SPD在合适水平来促进肿瘤发生发展的,目前尚不清楚。
近日,肯塔基大学Markey 癌症研究中心佘青柏课题组和南方医科大学南方医院消化科刘思德课题组合作在Nature Communications上发表题为Spermine synthase and MYC cooperate to maintain colorectal cancer cell survival by repressing Bim expression的学术文章。该研究发现SMS在结直肠癌中高表达, 这对平衡细胞中的SPD 水平以适应结肠癌的生长起着重要的作用。此外,该研究还详细阐明了SMS和MYC的协同促癌机制,为结直肠癌的治疗提供新的策略。

研究人员通过生物信息学分析、IHC和Western blot发现SMS在结直肠癌组织中的表达水平要明显高于正常的癌旁组织,提示SMS与结直肠癌的发生发展具有一定的相关性。接着研究人员利用shRNA和CRISPR/Cas9技术在不同结直肠癌细胞系中敲低或敲除SMS表达,均可观察到细胞的生长明显受抑制,细胞中PUT和SPM明显减少,而SPD则显著升高。另外,SPD在体外实验中能够抑制肿瘤细胞生长。因此,以上部分说明SMS对结直肠癌细胞的生长具有重要的作用,肿瘤细胞需要高表达SMS来代谢过多的SPD,从而使SPD维持在一个有利于肿瘤细胞生长的合适水平。
癌基因MYC在结直肠癌中也是高表达,并且在结直肠癌中广泛地被激活,参与调控结直肠癌的生长、侵袭和转移,MYC能够促进多个参与多胺合成酶的表达来提高多胺的水平,而多胺反过来亦能促进MYC表达。研究人员接下来探讨SMS和MYC的相互作用对肿瘤生长的影响及联合抑制SMS和MYC的抗肿瘤效果,体外和体内实验发现单独抑制SMS 或MYC的表达不足以有效引起结直肠癌细胞凋亡和抑制肿瘤生长, 但联合抑制SMS和MYC的表达则具有协同的抗肿瘤作用, 显著引起细胞凋亡和肿瘤消退。在机制方面,抑制SMS的表达能够通过增加SPD的水平来抑制乙酰基转移酶EP300的活性,从而抑制转录因子FOXO3a的乙酰化,使FOXO3a核转位增多,增强其转录活性,促进促凋亡蛋白Bim的表达。然而,转录增加的Bim mRNA会受到miR-19a和miR-19b的作用而降解。miR-19a和miR-19b受MYC的调控,MYC的激活能够上调miR-19a和miR-19b的水平。相反,抑制MYC的表达则会降低miR-19a和miR-19b的水平,从而减少其对Bim mRNA的降解,使Bim的表达进一步升高。重要的是,当在SMS 敲除的细胞中敲低Bim表达后,联合抑制SMS和MYC的表达所引起的细胞凋亡和抗肿瘤生长会有明显的减少,这些结果证实Bim是整合SMS/SPD/EP300/FOXO3a和MYC/miR-19a/b两个信号通路协同促进结直肠癌细胞生长的关键节点。综上所述,本次工作揭示了SMS和MYC信号之间的新型协同关系,以通过不同的调控机制共同抑制其共同的下游靶点,即促细胞凋亡蛋白Bim,从而维持结直肠癌细胞的存活。此外, 联合抑制SMS和MYC信号可诱导细胞死亡和肿瘤消退,这或许能为结直肠癌的治疗提供新的靶点和策略。
南方医科大学南方医院消化科郭予斌博士研究生作为肯塔基大学Markey 癌症研究中心的访问学生为论文的第一作者。佘青柏教授与刘思德教授为本文的共同通讯作者。
来源:BioGossip BioArt
原文链接:https://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652490315&idx=6&sn=6c09f1d491c375e936b6890192847efc&chksm=84e259ffb395d0e941dc68e6b45109c6422327da6fa13e8bd0c1653beac787be113caccfcd53#rd
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
第十七届全国大肠癌学术大会召开

PNAS:肠道菌群失衡促进大肠癌发作

世界癌症日 大肠癌专委会在行动
HIO大肠癌专题:中国直肠癌整合诊治指南

【癌症知多少】有关大肠癌(2)

港科大破解大肠杆菌素致癌机制有助推动大肠癌研究
第十七届全国大肠癌学术大会召开
大肠癌易盯上青年人,预防大肠癌需注意些什么?
中国抗癌协会王瑛秘书长出席河北省肿瘤防治宣传周启动仪式




张泽民等团队揭示大肠癌患者肿瘤反应性CD8 + T细胞的独特表观遗传特征