来源:BioArt
责编 | 酶美
磷酸二酯酶
(PDE)家族成员广泛地分布在哺乳动物各种组织中,其经典功能是通过磷酸二酯酶活性水解细胞内广泛存在的第二信使cAMP和cGMP成相应的一磷酸盐,在信号转导过程中发挥重要功能。PDE超家族包含至少11个成员
(PDE1~11),每个成员包括1~4个基因,每个基因由于mRNA转录起始位点或者拼接方式不一致又编码不同的蛋白亚型,导致在哺乳动物细胞中至少有100多个不同的PDE蛋白。由于PDE家庭成员数目多,组成复杂,在不同的细胞或者亚细胞水平分布,因此对不同的细胞功能具有选择性调控。
PDE蛋白的小分子抑制剂开发长时间以来是学术界和工业界的热门研究内容。其中,最为有名的是1998年批准的Sildenafil以及随后上市的Vardenafil和Tadalafil,这些抑制剂通过抑制PDE5而用于治疗勃起功能障碍,在全世界获得巨大成功。现今几乎所有的PDE抑制剂都用于抑制催化活性域中的cAMP/cGMP结合位点。但是由于PDE蛋白家族成员酶活性功能域的高度同源性,导致抑制剂选择性差,造成早期PDE抑制剂研究并不顺利,甚至带来多重副作用。
PDE3家族包含PDE3A和PDE3B两个成员。PDE3A主要在心脏、平滑肌、血小板、胃肠道、胰腺、子宫内膜、输卵管、卵巢和肾脏中表达。PDE3A缺失的小鼠能正常存活,也能排出正常数目的卵细胞,但是卵细胞由于不能完成减数分裂,停留在生发泡期,导致雌性不育。PDE3的抑制剂能影响肌肉收缩和血管舒张,用于心脏病的治疗,例如Quazinone用于急性心脏病的治疗,Milrinone, Amrinone 和 Levosimendan用来治疗充血性心脏衰竭。此外,PDE3/PDE4的抑制剂Zardaverine有扩张支气管的效果,用于哮喘的治疗;Cilostazol用来治疗间歇性跛行和血栓。虽然PDE3抑制剂能够用于多种疾病的改善,但是长期抑制PDE3的活性被证明可能会引起心脏病人猝死,影响女性卵细胞成熟等风险。
1999年,研究发现Cilostazol抑制了结肠癌细胞的移动,具有抗肿瘤转移的潜力,这是早期关于PDE3抑制剂有潜力用于癌症治疗的记载。2001年,Taku等人发现PDE3的抑制剂能够抑制下颌下腺肿瘤细胞HSG细胞的增殖。虽然并不清楚其抑制机理,但是作者提出PDE3抑制剂可以用于癌症治疗的观点。2006年,一项面向靶点已知的小分子进行的基于表型的筛选,找到多个PDE3的抑制剂诱导HeLa细胞凋亡。2014年,一项针对PDE3/4的抑制剂Zardaverine抗肝癌细胞HCC活性研究首次提出Zardaverine诱导的细胞凋亡与PDE3/4酶活性的抑制并没有关系,因为PDE3的抑制剂Trequinsin和PDE4的抑制剂Ralipram能够降低PDE的活性增加细胞内cAMP的水平但是并不能杀死HCC细胞。2016年,研究发现一个细胞毒性小分子DNMDP造成细胞凋亡与PDE3A的表达成正相关,并验证了DNMDP能直接结合PDE3A,促进PDE3A与SLFN12的结合,诱导细胞凋亡。
2019年,王晓东实验室博士后李典镕偶然发现人体内包括雌激素
(E2)在内的一类小分子在高于生理作用浓度时能够诱导多种癌细胞凋亡(Molecular Cell | 王晓东团队发现雌激素诱导细胞凋亡的分子学机制及其生理学意义)。博士后艾有为通过遗传学筛选发现E2诱导的细胞凋亡依赖于PDE3A/SLFN12的表达,并且发现E2通过直接结合PDE3A来诱导PDE3A-SLFN12的结合。随后李典镕博士等揭示PDE3A-SLFN12诱导细胞凋亡的机理。NIBS齐湘兵课题组在协助艾有为博士进行雌激素小分子化合物结构优化的过程中,介绍其课题组正在研究一类乌檀属生物碱小分子,发现这些小分子也能诱导癌细胞凋亡。
乌檀属类生物碱是从Nauclea subdita树皮中分离的一类复杂的多环吲哚生物碱。由于结构复杂分离效率很低,对于这一类生物碱的生物活性研究一直受限制。2016年,华东师范大学高栓虎课题组发展了一种分子内exo-氢胺化串联内酰胺化反应,无需过渡金属活化,在温和的条件下,以优秀的区域选择性构筑吡咯并吡啶酮和吡啶并吡啶酮等杂环。此反应通过共轭效应对炔烃产生极化作用,有效驱动了串联反应的发生,并控制了反应的区域选择性。基于此串联反应,通过灵活改变碳链长度,环状结构类型,完成了包括:喜树碱、22-hydroxyacuminate、oxypalmine、norketoyobyrine、nauclefine、naucleficine等喜树碱类,乌檀属和原小檗类生物碱合成,及35个类似物的多样性制备
【1】。为了探索这些小分子化合物的生物学功能和价值,高栓虎课题组与齐湘兵课题组合作发现这类吲哚生物碱小分子化合物对多种癌细胞具有杀伤效应,并在系统地解析这一类生物碱的结构和活性关系基础上,对这一类化合物进行了细致的构效关系优化。最后发现其中的
Nauclefine小分子诱导细胞死亡只需要几个nM,但是其诱导细胞死亡的生化机理并不清楚。近日,王晓东实验室艾有为通过与高栓虎课题组和齐湘兵课题组等多个课题组展开合作,在Nature Communications发表题为
An alkaloid initiates phosphodiesterase 3A–schlafen 12 dependent apoptosis without affecting the phosphodiesterase activity的研究。
该发现揭示了nauclefine介导细胞凋亡的机理。
本研究通过对靶点已知的小分子库进行筛选,发现多个PDE3抑制剂能够完全抑制Nauclefine诱导的细胞死亡,提示PDE3蛋白可能参与Nauclefine诱导的细胞死亡过程。通过遗传学敲除PDE3A或者其结合蛋白SLFN12的细胞,发现Nauclefine与上述报道的多个小分子化合物一样,通过PDE3A-SLFN12依赖的方式诱导细胞凋亡,并且在小鼠成瘤模型中抑制了肿瘤的生长。通过pull down结合LC-MS/MS质谱鉴定的方法,验证了Nauclefine与PDE3A的结合,但是与已知的PDE3A酶活性抑制剂DNMDP结合模式并不完全一样。于是作者继续探索了Nauclefine能否抑制PDE3A的磷酸二酯酶活性。体外酶活性实验结果表明Nauclefine并不能抑制PDE3A对cAMP的水解,表明这是一个全新的小分子化合物,能够结合PDE3A,诱导PDE3A-SLFN12的结合,但是并不抑制PDE3A的酶活性。因此,这项研究表明Nauclefine代表一类全新的小分子化合物,这类小分子化合物有潜力用于癌症治疗,并且能避免由于抑制PDE酶活性带来的多重副作用。
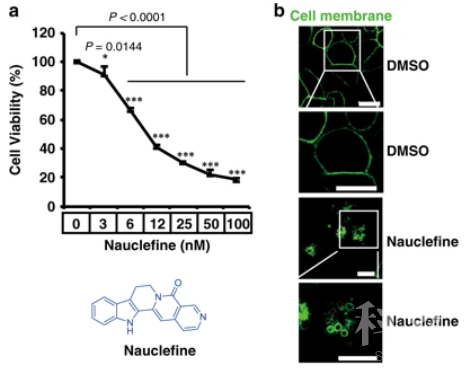
先前的研究表明发展小分子化合物诱导PDE3A与SLFN12相互作用成为一种新型的抗癌治疗方式。高表达PDE3A与SLFN12是筛选有潜力用此方式进行治疗的癌症病人的分子标志物。但是,由于PDE抑制剂特异性差,并且长期抑制PDE3的酶活性可能会带来心脏病人猝死,抑制女性生育,降低血小板树数目等副作用的风险。因此,
本研究提示发展类似于Nauclefine的不抑制PDE3酶活性、但是诱导PDE3A与SLFN12相互作用、进而引起癌细胞凋亡的小分子化合物成为新的抗癌药物研发方向。原文链接https://www.nature.com/articles/s41467-020-17052-4#Bib1
来源:BioGossip BioArt
原文链接:https://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652490335&idx=4&sn=2b6c28ab8c9c9c40fb9eaa7666e1a950&chksm=84e259ebb395d0fddf46e657bad627c994986fa8d90020a20fddd2aa06d1dcd43753887a05eb#rd
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn