科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-07-12
来源:iNature
许多研究表明,CRISPR-Cas9系统是一项革命性技术。这种相对易于使用的技术为科学研究和疾病治疗提供了前所未有的机会,包括在高通量筛选和功能基因组学研究中的应用以及病毒感染,遗传疾病和癌症的治疗。尽管如此,CRISPR-Cas9系统现在存在几个众所周知的缺点,包括脱靶编辑的可能性以及随之而来的时空控制编辑需求。
2020年7月10日,华东师范大学叶海峰团队在Science Advances 在线发表题为“Engineering a far-red light–activated split-Cas9 system for remote-controlled genome editing of internal organs and tumors”的研究论文,该研究描述了一种远红外光(FRL)激活的Split-Cas9(FAST)系统,该系统可以在哺乳动物细胞和小鼠中强烈诱导基因编辑。
通过基于发光二极管的FRL照明,FAST系统可以有效地编辑人类细胞中多个基因座的基因,包括非同源末端连接和同源性定向修复。此外,该研究显示FAST可以很容易地在tdTomato报告基因小鼠中实现FRL诱导的内部器官编辑。最后,在小鼠异种移植肿瘤模型中,证明FAST可以实现PLK1癌基因的FRL触发编辑。除了扩展用于CRISPR-Cas9技术的光遗传学工具箱中的光能谱外,这项研究还展示了FAST系统如何可以在生物学和生物医学领域中用于可编程的深层组织基因编辑,以实现高精度和空间特异性。

来源:Plant_ihuman iNature
原文链接:https://mp.weixin.qq.com/s?__biz=MzU3MTE3MjUyOA==&mid=2247511834&idx=7&sn=a68879d47892cbec9b63588d84449d52&chksm=fce6dcc5cb9155d33c27dd0995f69d8fe0998b8b8ee20fb4878ed461d4b2965168cd2d1273f9#rd
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
科技日报四问“基因编辑婴儿”

一种超快的CRISPR-Cas9基因编辑技术 几秒钟内实现精准基因编辑!

让Crispr-Cas9基因编辑技术与类器官培养研究如虎添翼的利器

暗处看手机对眼睛伤害有多大
编辑基因创造超人,霍金的担心是不是杞人忧天




中国科学家培育出基因编辑瘦肉猪:脂肪少24%
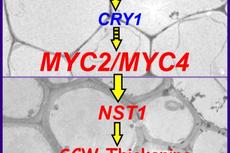
研究发现蓝光有助于植物合成坚硬细胞壁----中国科学院
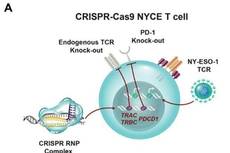
Science:利用CRISPR-Cas9编辑T细胞多个基因进行免疫治疗

Science:科学家发现新型基因编辑工具,体积是CRISPR-Cas9的一半!
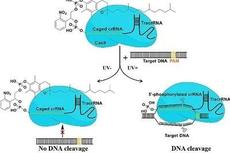
新型光敏CRISPR-Cas9系统实现基因编辑的光调控