科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-07-12
来源:DeepTech深科技
7 月 9 日,Fate Therapeutics 宣布 FDA 批准其 CAR-T 细胞疗法 FT819 新药临床试验申请(IND),这是 FDA 批准的第一个由 iPSC 衍生的通用型 CAR-T 细胞疗法的 IND。该公司将会推进 FT819 的临床研究,该药的适应症是复发性 / 难治性 B 细胞恶性肿瘤,包括慢性淋巴细胞性白血病(CLL),急性淋巴细胞性白血病(ALL)和非霍奇金淋巴瘤(NHL)。
一个典型的 CAR 通常包括一个胞外抗原结合域、一个铰链区、一个跨膜结构域、一个 T 细胞激活结构域和一个或多个胞内共刺激结构域组成。自问世以来,CAR-T 细胞疗法经过了漫长的发展过程,日渐走向成熟。现阶段,CAR-T 细胞技术已经发展到了第五代
但是,CAR-T 细胞疗法需要提取患者自已的 T 细胞 ,在体外经过工程化改造然后回输到患者体内,极具个性化。一种疗法针对一个患者,每个患者的细胞和接受过的治疗都不同,制备相对复杂,生产周期比较长,费用也比较高。于是,研究人员开始探索生产一种通用型 CAR-T 细胞疗法,改变传统针对每个患者都需要重新提取 T 细胞并进行工程化改造,采用同种异体方式生产出“现货”CAR-T 细胞疗法,满足患者的需要。
Fate Therapeutics 是一家处于临床阶段的生物制药公司,正在开发针对癌症和免疫疾病的一系列细胞免疫疗法。通过使用其专有的 iPSC 产品平台生成可再生诱导多能干细胞(iPSC)产品线,批量生产现成的工程化同种细胞产品,可以多次给药,更有效提高药理活性。人类 iPSC 具有独特的双重特性,即无限的自我更新和分化为所有细胞类型的潜力。
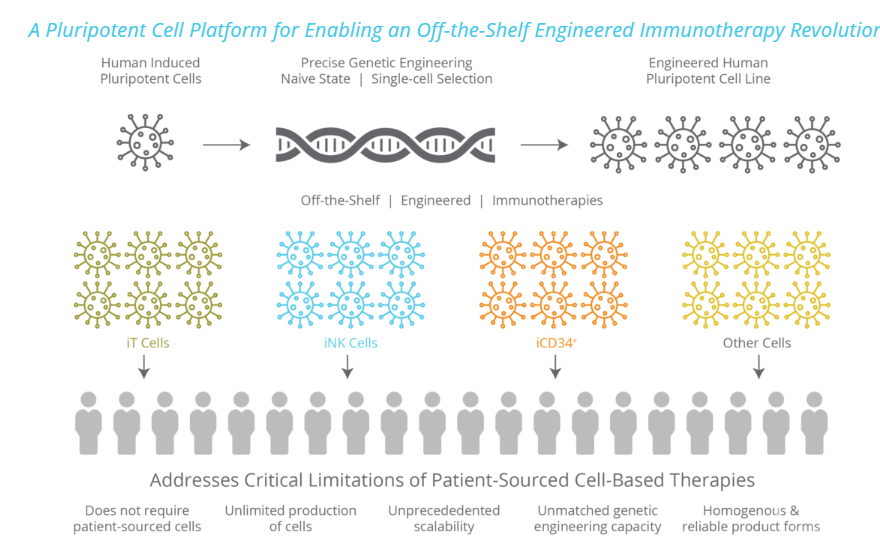
该公司主打产品 FT819 就是这样一种基于 iPSC 的通用型 CAR-T 细胞疗法,由纪念斯隆凯特琳癌症中心细胞工程中心主任兼基因表达与基因转移实验室负责人 Michel Sadelain 博士领导研发。它是一种现成的 CAR - T 细胞癌免疫疗法,来源于克隆工程的 iPSC 系统,能把靶向 CD19 的新型1XX CAR 插入T 细胞受体α恒定(TRAC)位点,并通过基因编辑消除 T 细胞受体(TCR)表达,减轻移植物抗宿主病症状。其专门解决与当前患者自体和供体来源的 CAR-T 细胞疗法限制,提高 CAR-T 细胞疗法的安全性和有效性。
根据临床前试验数据分析,FT819 能长时间抑制肿瘤,延长生存期。在弥散性淋巴细胞白血病的异种移植模型中,与原代 CAR19-T 细胞相比,FT819 能进一步清除肿瘤和抑制白血病发展。给药后第 35 天,骨髓评估显示 FT819 具有持续清除肿瘤的能力。临床 I 期试验则是旨在确定 FT819 的最大耐受剂量,并评估在 297 名成年患者中,FT819 用于治疗三种类型 B 细胞恶性肿瘤(CLL,ALL 和 NHL)的安全性和临床活性。
今年 5 月份,FDA 已经批准了该公司 NK 癌症免疫疗法 FT538 的 IND 申请,允许开展 FT538 治疗肿瘤的临床试验。FT538 是第一个 CRISPR 编辑的 iPSC 衍生细胞疗法,其衍生自 iPSC,且经过工程改造,可增强先天免疫力。在临床前试验中,FT 538 显示强大的的 NK 细胞效应功能,通过多种机制相互作用,可增强患者体内的抗肿瘤活性。

近年来,免疫疗法在癌症治疗领域可谓占尽风头,尤其 CAR-T 细胞疗法更是取得了前所未有的突破。CAR-T 细胞治疗布局火热,可谓是一派百花齐放的态势,下面回顾一下国内外 CAR-T 细胞疗法的发展历程。
2014 年,CAR-T 细胞治疗已在急性淋巴细胞白血病 (ALL) 中取得显著疗效,给血液恶性肿瘤的治疗带来了希望;2017 年,已经有两种 CAR-T 细胞疗法,获得美国 FDA 批准上市,分别是 Kymriah(诺华公司)和 Yescarta(Kite Pharmar 公司),开启了人类肿瘤免疫治疗新篇章,活细胞开始作为一种全新的药物形式用于肿瘤治疗;2018 年 4 月,辉瑞与 Allogene Therapeutics 合作开发同种异体 CAR-T 细胞疗法(通用型 CAR-T 细胞疗法);同年 6 月,美国 FDA 批准了 Cellectis 第三款同种异体 CAR-T 细胞疗法—UCART22 的新药临床试验申请(IND);今年 7 月,Anixa Biosciences 公司的新型 CAR-T 细胞癌症治疗技术获首项欧洲 CAR-T 细胞专利,目前正在美国莫菲特癌症中心进行。
国外布局火热,制药巨头们纷纷参入,国内企业也不甘示弱。
2018 年 3 月,南京传奇生物的 BCMA CAR-T 细胞疗法获得临床试验批件,是中国第一个获得 CAR-T 细胞药物临床试验申请 (IND) 批件的产品;2020 年 2 月,复星医药宣布复星凯特 CAR-T 细胞产品上市申请获得国家药监局受理;4 月,亘喜生物报告其通用型 TruUCAR™ GC027 产品的 Ⅰ 期临床试验数据;同月,艺妙神州的 CAR-T 细胞疗法药物 IM19 也获得批临床试验。不过遗憾的是,目前国内还没有一个 CAR-T 细胞产品正式获批上市。
此外,无论是传统 CAR-T 细胞疗法还是通用型 CAR-T 细胞疗法,研发之路并非一帆风顺。今年 7 月,Cellectis 公司的临床试验 MELANI-01 已被美国 FDA 紧急叫停,原因在于其通用型 CAR-T 细胞疗法 UCARTCS1A 导致一名患者死亡,这也为 CAR-T 细胞疗法敲响了警钟。
尽管 CAR-T 细胞疗法面对挫折,但不代表 CAR-T 细胞疗法就进入了寒冬期。国内外 CAR-T 细胞疗法赛道布局仍然火热,其主导地位暂时不会发生改变。在看好 CAR-T 细胞疗法的同时,也要认知到 CAR-T 细胞疗法的发展之路任重道远。
来源:deeptechchina DeepTech深科技
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3NTIyODUzNA==&mid=2649594685&idx=5&sn=032a3e87a3b44204212a6a528ff0d8fd&chksm=876a8f24b01d0632e261e30ceabcba794c913252f8eeeb9f4f30c8e493f687335a517bf05dea&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
肿瘤免疫疗法治疗艾滋病,新型CAR-T细胞可清除体内97%受感染细胞
中国抗癌协会整合肿瘤学分会成立大会在西安召开



Nature新发现:CAR-T细胞疗法可用于治疗心脏病
Nature Biotechnology:为CAR-T细胞疗法加个开关

Nature | 华大自主平台再次助力发高分,揭CAR-T疗法T细胞耗竭主因

CAR-T细胞疗法最新研究进展
中国抗癌协会王瑛秘书长出席河北省肿瘤防治宣传周启动仪式



哈佛大学医学院Kucherlapati教授访问中国抗癌协会


CAR-T新型细胞疗法应用:选择性清除白血病干细胞

Nature突破:CAR-T细胞疗法有望治疗心脏病