科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-07-26
来源:BioArt
羊毛硫肽(lanthipeptides)是天然产物核糖体合成和翻译后修饰肽(RiPPs)中的一大类,以分子内硫醚交联键(称为羊毛硫氨酸(lanthionine)和甲基羊毛硫氨酸(methyllanthionine)残基)为特征,具有抗菌、抗病毒等多种活性。合成羊毛硫肽的基因簇成簇排列,其中生物合成基因包括前体肽基因(N端的前导肽和C端的核心肽),翻译后修饰(post-translation modification, PTM)基因和蛋白酶基因。此外,由于大多数羊毛硫肽都具有抗菌性,因此微生物为保护它们自己不受羊毛硫肽的侵害,在基因簇上还包含了免疫基因、转运基因及调节基因等。基因组学研究表明目前已知结构的羊毛硫肽类天然产物仅仅占很小一部分,有大量未知的羊毛硫肽有待发现和阐明,具有广阔的研究前景。
羊毛硫肽由多种微生物产生,但很多微生物在实验室条件中无法培养或者在实验室条件下无法产生羊毛硫肽。虽然研究人员开发了大肠杆菌、乳酸菌等异源表达系统进行新羊毛硫肽的挖掘和筛选,但由于羊毛硫肽在大肠杆菌中表达时容易形成包涵体,并且由于大多数羊毛硫肽具有抗菌性,因此在异源宿主内挖掘新的羊毛硫肽也受到限制。此外,由于该类抗生素具有巨大的工业和医用价值,因此对提升该类抗生素的产量有迫切需求,然而由于原始宿主的遗传操作系统较难及羊毛硫肽的产生受到严格的胞内调控等因素,其产量提升较为困难。因此该领域面临两大核心问题——如何高效发现新的羊毛硫肽以及如何将现有重要的羊毛硫肽高产?
近日, Advanced Science发表武汉大学药学院刘天罡教授团队的最新研究成果,论文题为“A Cell-Free Platform Based on Nisin Biosynthesis for Discovering Novel Lanthipeptides and Guiding Their Overproduction In Vivo”。

武汉大学药学院刘天罡课题组针对羊毛硫肽这些问题,开发了一套无细胞蛋白合成平台(cell-free protein synthesis, CFPS),以羊毛硫肽中典型代表乳酸链球菌素(nisin)为示例验证无细胞体系在高效发现新的羊毛硫肽(天然未知nisin类似物的基因组挖掘和饱和突变的nisin突变体的筛选)及指导羊毛硫肽类高产的优越性。
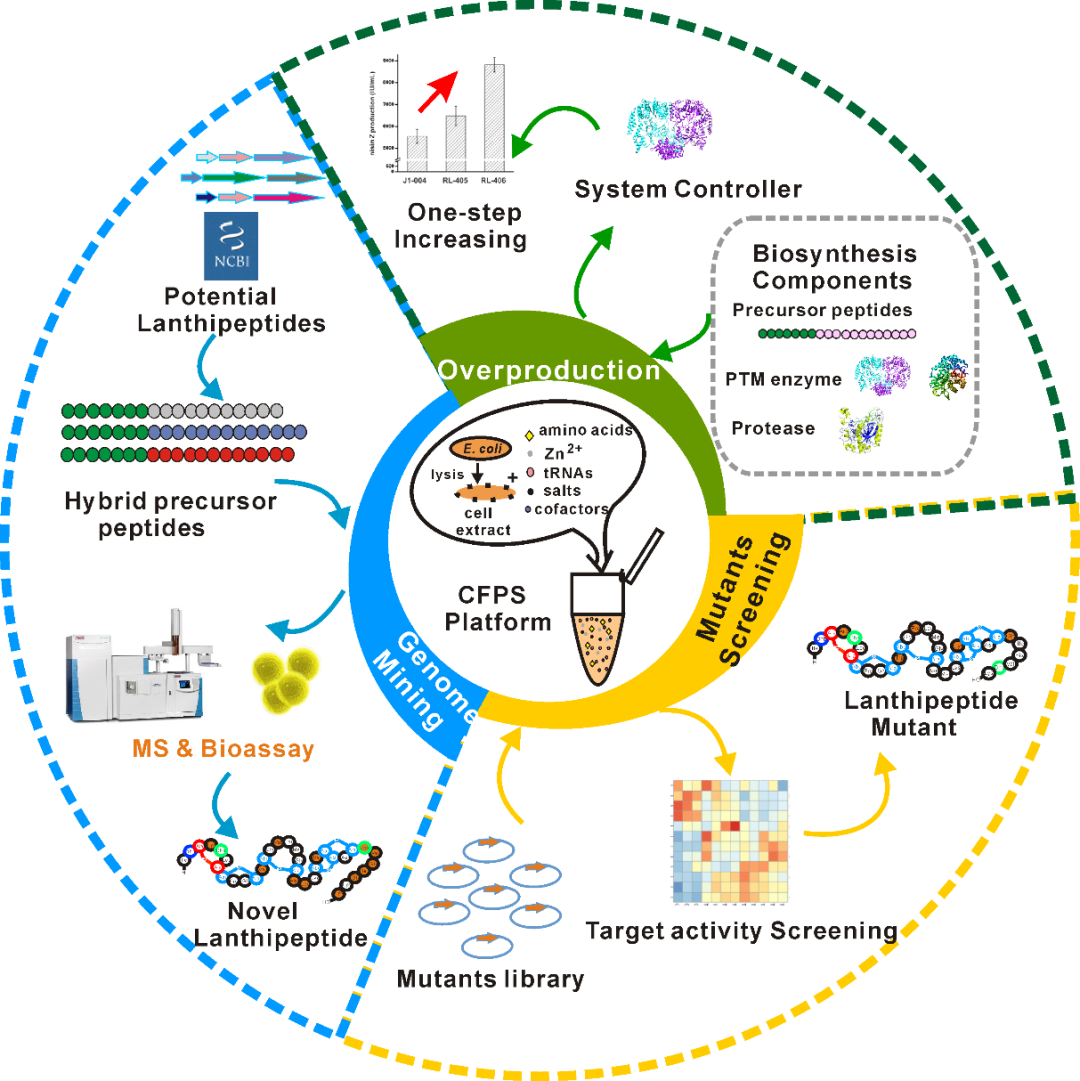
CFPS platform for Lanthipeptides research
在这项工作中,作者首先构建了基于大肠杆菌的无细胞蛋白合成系统,该体系中包含大肠杆菌的提取物、必需的底物、盐溶液、辅因子等能够满足转录翻译的所需原料。在该系统中,将nisin生物合成所需的四个基因质粒(pJL1-nisZ合成nisin的前体肽NisZ, pET28a-nisB合成PTM中的脱水酶NisB,ppET28a-nisC合成PTM中的环化酶NisC,以及pET28a-nisP合成蛋白酶NisP用于切割NisZ的前导肽)按照0.5 nmol L-1的浓度分别加入CFPS体系中,30度孵育。作者验证,在孵育6 h后,将该CFPS体系浓缩20倍后,通过LC-MS-MS及琼脂扩散法生物测定检测到nisin的合成。
下一步,作者通过western blotting验证目前搭建的CFPS体系中只能检测到明显的NisZ大小的条带,因此他们将nisin合成中翻译后修饰及NisB, NisC和NisPs(截短的仍具有功能的NisP)进行纯化,将原CFPS中的相应的质粒用500 nmol L-1的相应蛋白进行依次替换,结果表明NisB和NisC的替换都能增加产量,NisP的替换对产量几乎没影响。因此,为了提高CFPS合成nisin的产量,作者将nisin的CFPS体系确定为nisZ和nisP用质粒表达,而nisB和nisC直接用纯化的蛋白替换。接下来,作者通过系统的滴定实验证明,NisB的合成是nisin合成的限速步骤,并确认四种组分的最优浓度。作者随后用相应最优浓度的pJL1-nisZ,pET28a-nisP,NisB和NisC构建了nisin高效合成的CFPS平台。
羊毛硫肽在生物合成时都遵守一个规律,即它们的PTM酶往往通过前体肽的前导肽上的保守氨基酸进行识别,然后催化核心肽上的Ser和Thr发生脱水,这些脱水残基由环化酶与Cys反应形成硫醚键,而蛋白酶在核心肽形成硫醚键以后能够识别前导肽和核心肽间的位点,将前导肽进行切割后得到成熟的羊毛硫肽。PTM酶的催化过程对前导肽的保守区域要求严格,然而对核心肽的多变性容忍度较高。因此,对于nisin类的羊毛硫肽而言,可以将未知的羊毛硫肽与NisZ的前导肽相连,然后通过NisB, NisC和NisP催化就有可能合成成熟的羊毛硫肽。作者为了验证他们搭建的优化后的CFPS平台上具有对新的羊毛硫肽的基因组挖掘的能力,他们提取了NCBI数据库(截止2018年6月)中所有与nisin结构类似的羊毛硫肽的核心肽的序列,通过层层过滤的方法最终筛选到18个未知功能的羊毛硫肽,将NisZ的前导肽通过基因合成的方式合成“杂合”的前体肽质粒(共计18个)。在一天之内,将这些质粒依次替换原来优化后的CFPS体系中的pJL1-nisZ进行孵育(Figure 1A),并通过LC-MS-MS鉴定,其中有6个核心肽发生了脱水反应,通过琼脂扩散实验证明其中4个有抑制藤黄微球菌的活性。在此过程中,他们通过设置阳性对照(前人利用类似方法在体内筛选得到的nisin类似物Bagelicin)验证了CFPS平台对于筛选nisin类似物的可靠性。接着,作者对这4个新的羊毛硫肽(RL6, RL8, RL13, RL14)进行了结构表征和活性测定(Figure 1B),结果表明,这4个新的羊毛硫肽具有很好的抑菌活性(包括对耐药菌MRSA的抑菌活性),其中1条对临床致病菌株粪肠球菌的抑菌活性优于nisin。
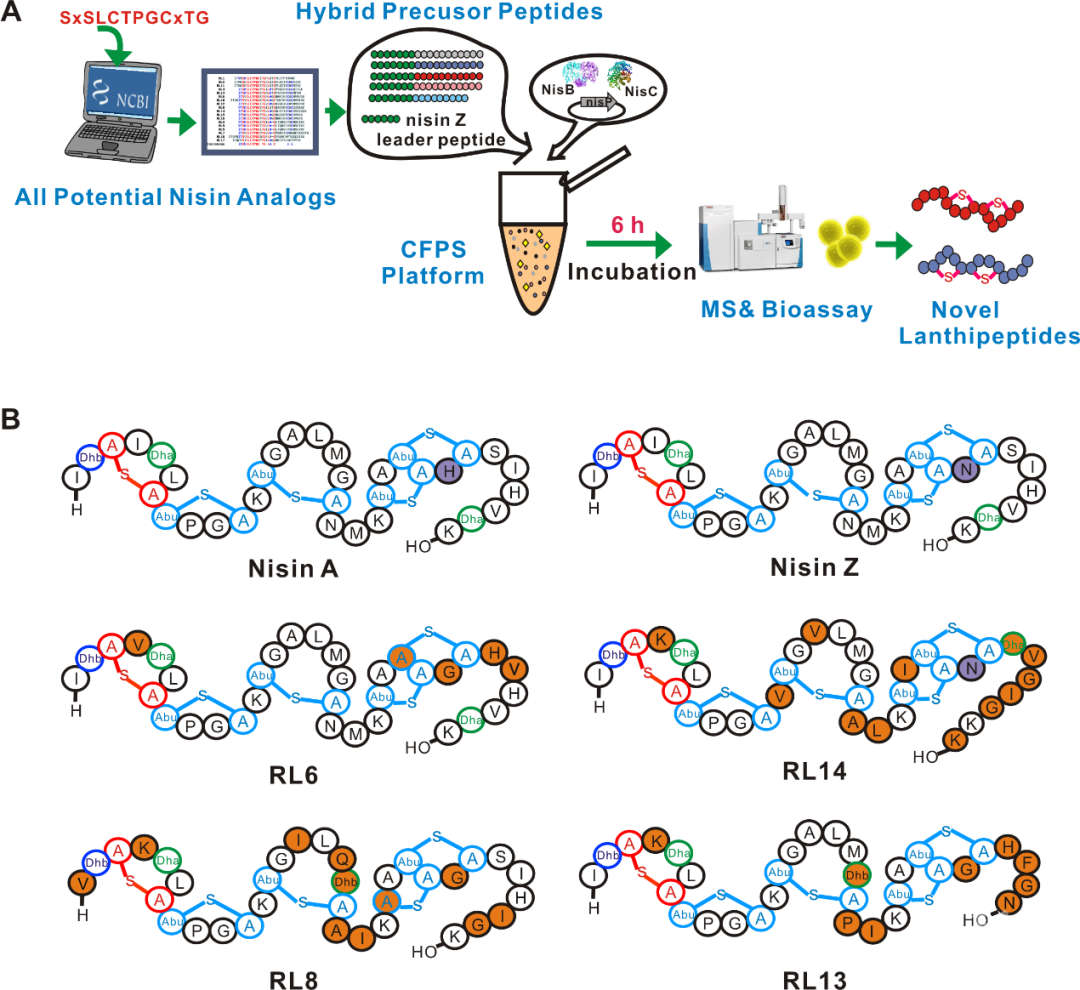
Figure 1. Rapid genome mining for novel lanthipeptides in CFPS.
由于天然羊毛硫肽大多具有抗革兰氏阳性菌的功能,因此除了对天然羊毛硫肽进行基因组挖掘,作者又尝试了利用CFPS对构建的nisin的突变体的文库进行筛选,利用于CFPS体积不到10微升的优势,用96孔板反应即可进行大量筛选,以期扩展羊毛硫肽的功能使其具有抗革兰氏阴性菌的功能。通过对位于核心肽上但不是形成硫醚键的5个氨基酸进行饱和突变,作者在利用搭建的CFPS平台对突变体文库进行筛选,筛选了约3000个突变体,最终从中筛选到一条有5个突变位点的羊毛硫肽M5, 具有在EDTA辅助下比nisin抗革兰氏阴性菌大肠杆菌更好的活性。
最后,作者在优化CFPS平台时已经锁定NisB为nisin合成的限速步骤,因此他们在工业nisin Z生产菌株Lactococcus lactis J1-004(经过多年诱变,遗传操作极为困难,因此只能进行有限的一步改造)中通过过表达nisZ得到工程菌株RL405,以及过表达nisZ和nisB得到工程菌株RL406。最终,RL406的产量相比于J1-004的产量提升近60%,达到8828 ± 336.2 IU mL−1。接着,他们在大肠杆菌异源表达宿主中也尝试nisB的过表达,最终将nisin类似物RL6的产量提升90%,达到260.1 ± 10.5 IU mL−1。通过这些实验,作者验证了nisB是一个针对nisin类羊毛硫肽生物合成的通用的限速因子,也证实了CFPS平台可以指导体内精准靶向改造。
总的来说,这项研究成果为高产羊毛硫肽及挖掘新的羊毛硫肽提供一种普适、快速、高效的方法,并且形成的CFPS平台也可应用于其他RiPPs的研究。同时,该项研究再次证实了无细胞合成体系在探究天然产物合成,特别是RiPPs类天然产物具有的优越性。
来源:BioGossip BioArt
原文链接:https://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652493071&idx=7&sn=b5f0470100b0eccb7ae7145d747bb81a&chksm=84e246bbb395cfad2e1d98e4684a4e5ffe6c4ca5e6a30b99f386a3f04da23872fc1771b3d019#rd
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
观察:“基因驱动”与合成生物学的未来

基因合成产业未老先衰?

合成生物学研究期待完美基因工具
深圳先进院等设计合成基因线路帮助精确定量细菌中的基因重排事件

研究发现参与导致小麦赤霉病的新分子

广东农科院完成栽培种花生基因组序列图谱测序!

《自然》:欧洲根据已知基因序列合成新冠病毒,助力疫苗开发

烟草糖酯合成新基因被发现

迄今最大合成基因组诞生:非全部密码子构建
肥胖女性绝经后乳腺癌风险骤增?可能是游离脂肪酸惹的祸!