来源:X一MOL资讯
Cre-loxP重组酶系统是一种位点特异的基因重组技术,可以迅速而有效地实现各种生理环境下的基因定点插入、删除、替换和倒位等操作,具有高效性,特异性强,应用范围广等特点
[1]。近年来,科学家将合成生物学理念融入Cre-loxP重组酶系统中,开发出了一系列调控式的Cre-loxP重组酶系统,如化学方法诱导的Cre-loxP重组酶系统和紫光/蓝光诱导的Cre-loxP重组酶系统
[2,3]。但是这些诱导系统仍然具有一定程度的毒性,并且紫蓝光的组织穿透性差,这些都极大地限制了Cre-loxP重组酶系统在动物体内的应用。
7月24日,华东师范大学生命科学学院、华东师范大学医学合成生物学研究中心叶海峰研究员团队在Nature Communications上发表最新研究成果,将合成生物学方法和光遗传学技术相结合,设计开发了一套远红光调控的分割型Cre-loxP重组酶系统(简称FISC系统),具有低毒、高度时空特异和强组织穿透性,成功实现在小鼠体内对靶基因的高效精确改造。叶海峰研究员为该论文的通讯作者,2017级博士研究生吴嘉丽、王美艳副研究员和2018届硕士研究生杨雪平为该研究论文的共同第一作者。
研究团队利用该课题组前期开发的远红光调控的哺乳动物细胞转基因表达控制系统
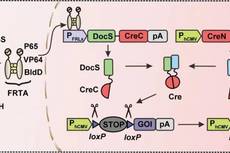
[4],将能响应远红光和合成c-di-GMP的光敏蛋白BphS、响应c-di-GMP的BldD蛋白以及Cre重组酶进行合理拼接组装。研究人员将Cre重组酶分成CreN59(第1–59个氨基酸)和CreC60(第60–343个氨基酸)两部分,其中CreN59与Coh2蛋白融合被组成型启动子表达,CreC60与DocS蛋白融合被远红光诱导表达(图1)。
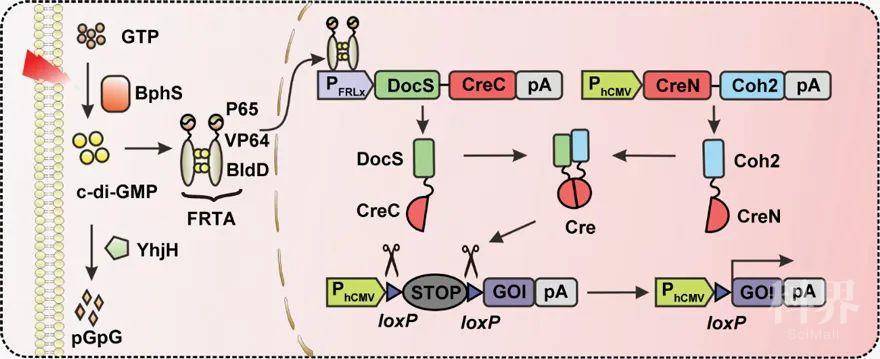
图1. FISC工作原理。在远红光照射下,细胞中的BphS利用GTP合成环二鸟苷酸c-di-GMP,c-di-GMP与转录激活结构BldD-P65-VP64 结合并进入细胞核,激活DocS-CreC60的表达;CreN59- Coh2在细胞中组成型表达。两部分Cre在DocS与Coh2蛋白相互作用下重新合成完整Cre重组酶,识别报告基因中loxP位点切除STOP序列,起始下游目的基因表达。首先,研究团队人员通过优化不同启动子、不同质粒量、蛋白间连接肽以及不同Cre重组酶作用序列,得到了最优版本的FISC系统,最佳诱导基因表达倍数高达约120倍。另外,在哺乳细胞中测试了FISC系统动力学表征,结果显示在不同的报告蛋白和不同的细胞系中,FISC系统都展现出良好的调控效果。在HEK-293细胞中,FISC系统具有光照强度和时间依赖性以及高度的时空特异性(图2)。
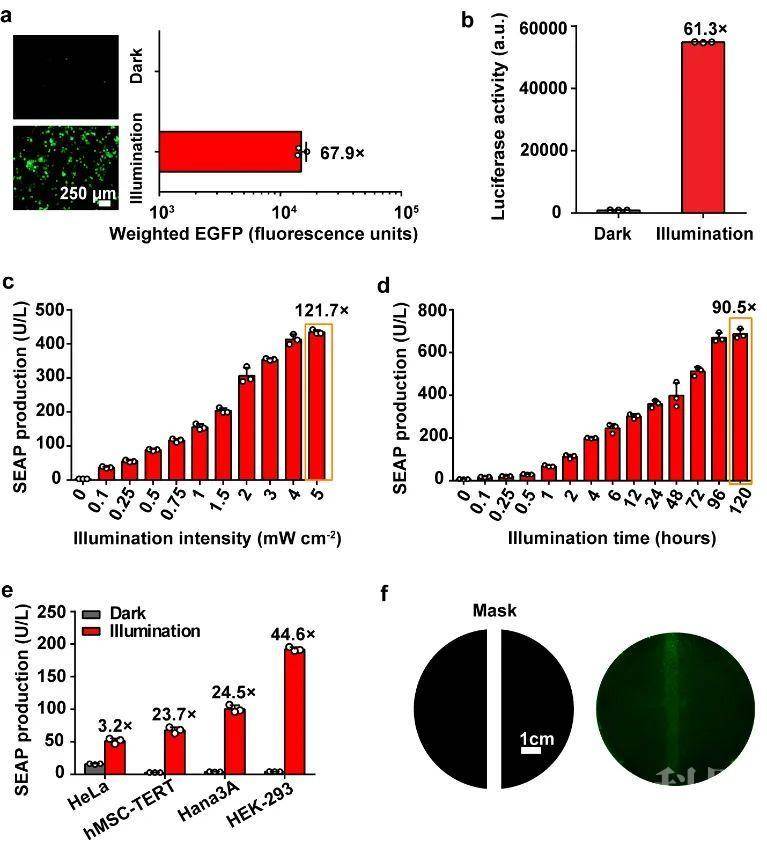
图2. FISC的动力学表征随后,研究团队人员通过流体动力学注射法将FISC系统递送到BALB/c小鼠体内,探究FISC系统在体内的工作情况,并与目前已发表的两套蓝光调控Cre-loxP系统进行比较,结果显示FISC系统在体内展现出更高效的基因重组效率(54.4倍),这也充分体现了远红光的组织穿透性优势,进一步证明了FISC系统在动物体内极具应用优势(图3)。
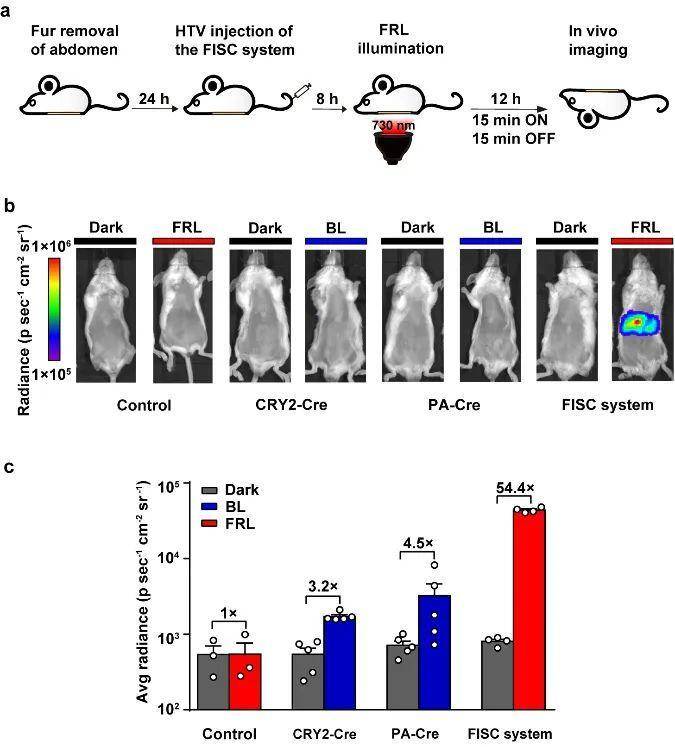
图3. FISC系统在小鼠体内介导DNA重组同时,研究团队人员采用电转的方法将FISC系统递送到tdTomato转基因报告小鼠肌肉中(Gt(ROSA)26Sor
tm14(CAG-tdTomato)Hze),小鼠经远红光照射后,在体内诱导合成的Cre重组酶会切割基因组上的loxP序列,切除STOP序列,表达tdTomato红色荧光蛋白。结果发现在mRNA和蛋白水平上FISC系统均展现出比蓝光调控的Cre-loxP系统更高的DNA重组效率。
为了实现体内高效递送,研究团队人员将FISC系统构建在AAV载体上,利用AAV病毒将FISC系统递送到tdTomato转基因报告小鼠中。通过观察小鼠活体成像和肝脏成像,与黑暗组小鼠相比,光照组小鼠红色荧光蛋白表达量显著升高(图4)。这说明利用AAV载体成功实现了FISC系统在小鼠体内介导的DNA重组。
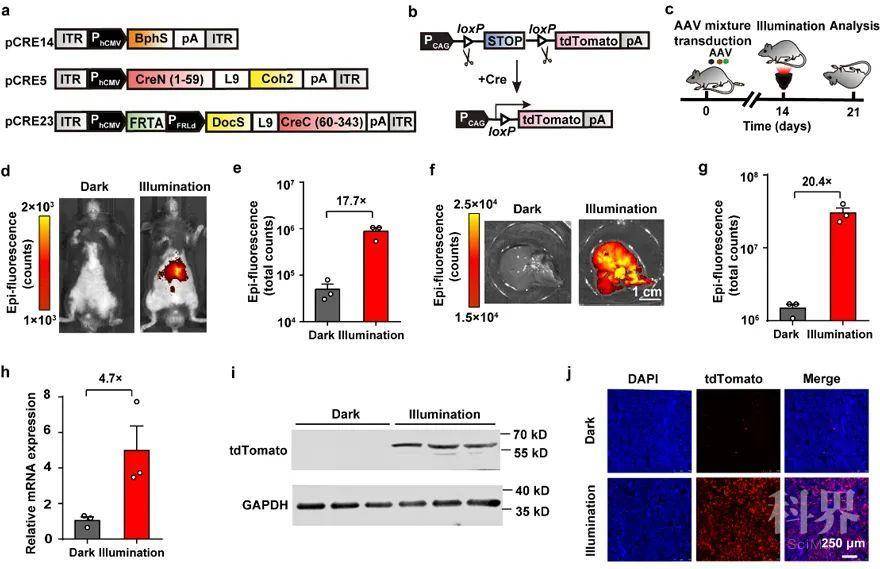
图4. AAV病毒将FISC系统递送到tdTomato转基因报告小鼠总之,FISC系统在体内外实现了精准可控的基因改造,并具有深度组织渗透能力和低毒性。这项研究将有望为细胞的命运图谱的研究、功能基因的研究以及动物模型的构建等提供一种新的策略和方法。
据悉,本研究是叶海峰课题组在光遗传学应用上的进一步的研究成果。2017年,该课题组在Science Translational Medicine 期刊上发表了一篇研究文章报道了一种远红光(730 nm,LED)调控的转基因表达控制系统,并实现了智能手机远程控制细胞释放胰岛素治疗糖尿病的目标
[4]。2018年,该课题组在美国科学院院刊PNAS 上报道了远红光调控的CRISPR-dCas9内源基因转录激活装置(FACE),可实现表观遗传操控以及诱导干细胞分化为功能性神经细胞
[5]。2020年,该课题组在Science Advances 上报道了一个远红光调控的分割型split-Cas9基因编辑系统(FAST),通过对小鼠肿瘤中的致癌基因进行编辑,成果实现了光控抑制肿瘤生长
[6]。该一系列系统性研究工作进一步拓展了光遗传学工具箱,为精准可控的细胞治疗和基因治疗奠定了研究基础,进一步推动了基于光遗传学的精准治疗和临床转化应用。
来源:X-molNews X一MOL资讯
原文链接:http://mp.weixin.qq.com/s?__biz=MzAwOTExNzg4Nw==&mid=2657651565&idx=5&sn=6679f9fa705a7ac4da2d374bb2a2587b&chksm=80f8a2bdb78f2bab93fbbd38e898cbbc67fad216cd674b00aa8b7393dadbf8d028ea89e61b01&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn