科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-08-04
来源:生物探索
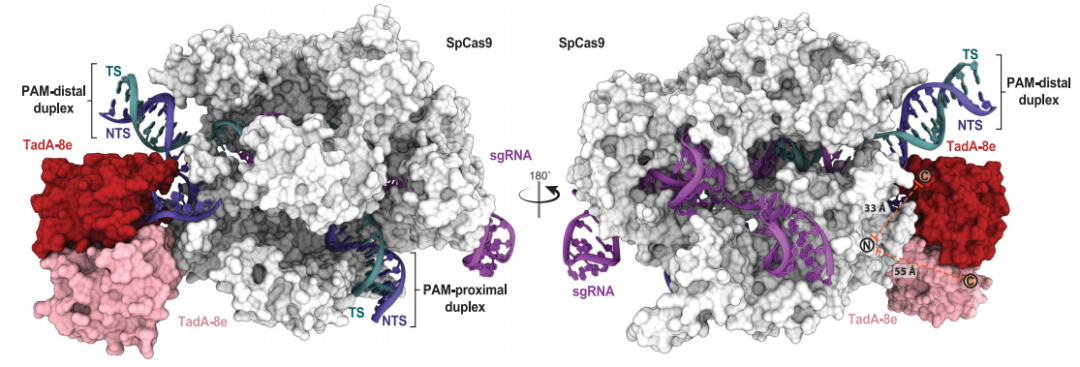
2012年,基因编辑领域两大先驱Jennifer A. Doudna和Emmanulle Charpentier合作发布了基因编辑史上的里程碑论文,为世界带来了革命性的CRISPR-Cas9系统。8年来,这把“基因魔剪”以惊人的速度在农业、药物开发和医学等领域得到广泛应用,并衍生出一系列基因编辑工具,成为人类改写自然遗传密码的首选基因组编辑器。
来源:biodiscover 生物探索
原文链接:https://mp.weixin.qq.com/s?__biz=MzU2MTQ2MDE0Ng==&mid=2247516527&idx=1&sn=954da75f941822ba0fb036ded0dbdb68&chksm=fc7aa7b2cb0d2ea40bdcdb286d74da94b4f1d79305a5206ccd92f0c78a6df1ac7147f68e1021#rd
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

自然中不存在的蛋白质也能人造了!撼动材料医药界
Yandex地图编辑器

夫妻相真的存在,研究发现夫妻DNA相似度高过陌生人
横空出世,一类新的编辑器诞生,David Liu首次对线粒体DNA进行编辑

新研究揭开人类头发曲直的秘密

David Liu:快速进化碱基编辑器可提高编辑效率

Nature子刊:单碱基编辑器助力肝病治疗

全新碱基编辑器“点对点”打击致病基因

DNA机器人一小步 癌症治疗一大步

Nature子刊:单碱基编辑器助力肝病治疗