科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-08-06
来源:ACS美国化学会
邻近细胞的相互作用在免疫响应、神经发育、神经冲动等多重生命过程中均起到关键作用。然而,由于神经系统的复杂性,相应的检测需要跨越纳米级至毫米级的尺度范畴,描绘动态的细胞间相互作用,目前仍是一大难题。现有的技术主要在其中一个尺度范围内采集数据:电子显微技术可以对神经突触成像,但难以研究整个神经网络;而荧光显微技术能够对组织成像,但分辨率受限,对比度也较低。
发展荧光成像工具是另一种检测细胞相互作用的方法。理想的荧光成像工具需要具有蛋白质相互作用传感器的全部优点,并且能够在组织中约20 nm(细胞相互作用的典型尺度)的尺度范围内发挥功能。荧光成像工具中,应用最广泛的是split荧光蛋白,能发射多种颜色的荧光,反映突触结构、功能的不同方面。该接触类传感器的主要局限是互补蛋白一旦结合后难以分开,导致split荧光蛋白不能瞬时进行报告。
FAP(Fluorogen Activating Protein)是一种融合蛋白,能够激活非荧光染料fluorogen,产生稳定、高亮度的荧光。FAP具有模块化的特点,适用于多种体系。此前作者基于FAP系统,已经开发了一种报告系统,用于时间分辨地检测蛋白质相互作用或邻近细胞相互作用:即两个fluorogen通过linker相连,FAP位于细胞表面,若出现共定位的荧光信号,说明两个FAP处于邻近位置。但是该系统中两对FAP/fluorogen是相互独立的,结合动态过于复杂,不便优化。因此,本文中,作者对此加以改进,开发了FAP-DAPA系统,借助HaloTag与HexCl的反应将fluorogen锚定在细胞上,实现邻近的荧光激活,并在体外实验和细胞实验中验证了FAP-DAPA的效果。体系中,荧光信号受到3个因素的影响:DAPA所连linker的长度、FAP与DAPA的结合能力、DAPA的浓度。另外,这篇文章在原有FAP基础上,通过采用亲和力更弱 、解离半寿期更短的FAP突变体,扩大该方法适用的浓度范围,对细胞接触位点进行高特异性的标记。
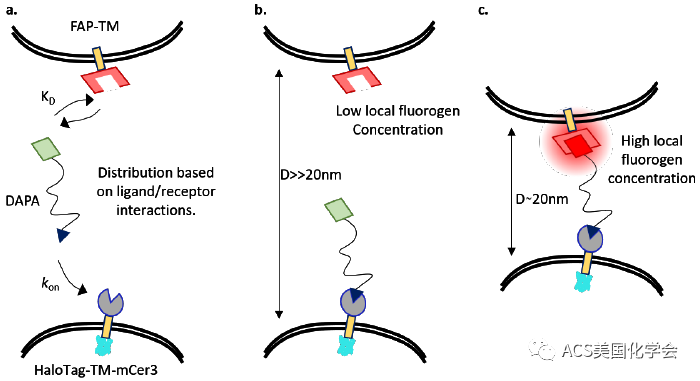
图1. FAP-DAPA系统检测邻近细胞相互作用的原理。
首先,作者合成了结构为MG-PEG-HexCl(MG:孔雀绿,一种fluorogen)的DAPA,并且分别检验了DAPA与FAP和HaloTag的结合能力。由于DAPA的局部浓度须低于FAP与DAPA的结合常数且高于HaloTag与DAPA的结合常数,作者进化了FAP的原始版本dL5**,得到了多种突变体,其中dK(E52K突变体)与dL5**的量子产率、亮度相近而结合常数显著降低,与fluorogen解离更快(如图2所示)。因此后续的FAP-DAPA系统中采用dK。
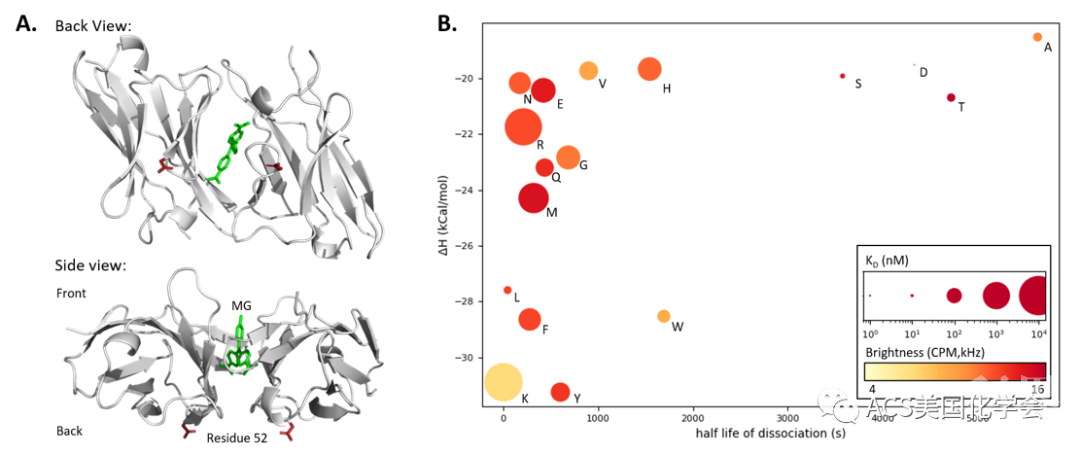
图2. 利用定点突变寻找结合弱、解离快的FAP突变体. (A) L5 FAP与fluorogen(MG)结合口袋的晶体结构(B)各种突变体与MG的结合焓及解离半寿期。
随后作者以已知的FKBP/FRP在rapamycin诱导下二聚的体系为例,证明了FAP-DAPA系统可用于检测蛋白质相互作用。将dK和HaloTag(HT)分别融合表达在FKBP和FRP上(尝试了不同组合),加入rapamycin后荧光信号明显增强,如图3所示。不同组合的荧光信号增幅不同,可能与FKBP/FRP二聚时采取特定的取向有关,可能二聚取向阻止了某些组合中dK与HaloTag的靠近。以上结果表明,在取向合适的相互作用体系中,FAP-DAPA系统能够监测蛋白质相互作用。如果今后开发出多种长度的linker及不同颜色的DAPA染料,也许可以实现根据不同颜色的荧光信号,实现蛋白质间距离的测量(即“分子尺”)。
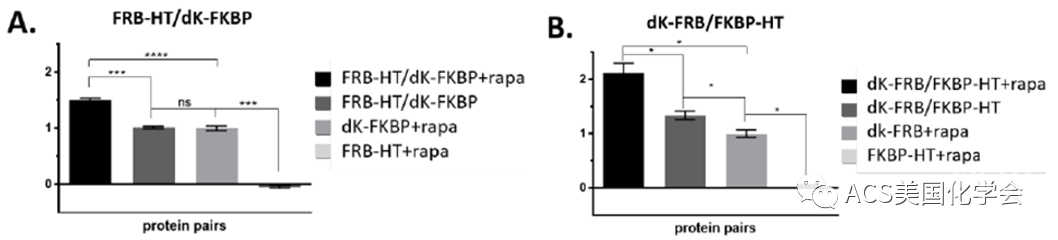
图3. FAP和HaloTag融合表达于FRB和FKBP上,诱导二聚后增强的荧光信号表明系统中存在依赖于蛋白质间距离的荧光激活. (A) 相互作用蛋白为FRB-HT和dK-FKBP时的荧光信号(B)相互作用蛋白为dK-FRB和FKBP-HT时的荧光信号。
为了能够观察细胞间的相互作用,作者首先检测了DAPA的透膜性,对于细胞表面成像来说,DAPA不透膜即可。实验结果也表明DAPA只对细胞表面表达FAP有荧光成像响应(此处未展示成像结果)。如果想要对细胞内的蛋白质互作进行成像,可以从化学角度对DAPA的理化性质进行改造,从而达到这种方法的相应目的。
最后作者分别在细胞表面表达FAP和Halo-tag. 在细胞中加入DAPA后,DAPA先共价连接到表达Halo-tag的细胞表面;如果附近有表达FAP的细胞,通过DAPA中的MG与FAP的结合,就会使细胞相互作用界面发出荧光。如图4所示,在10 nm的DAPA很好地展现了细胞间互作界面。此外,作者将两种细胞混合,对一个小时内的相互作用界面进行了动态实时监控(实验结果参见SI)。
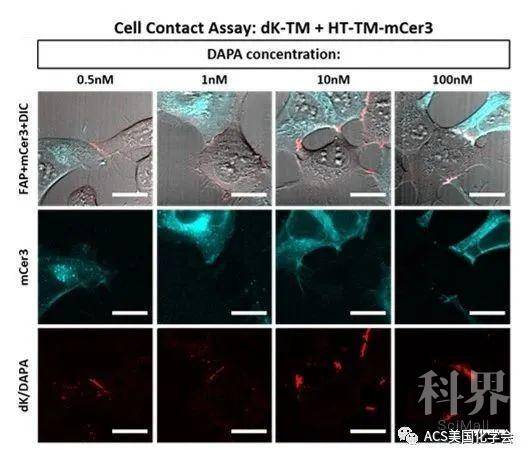
图4. 利用dK-FAP-DAPA系统对细胞间互作界面进行成像。
综上,改进后的dK-FAP-DAPA系统能够高特异性、高对比度地报告蛋白质或细胞间的邻近关系,并且受动态相互作用的影响较小。因此,本文中的FAP-DAPA标记系统经过适当的靶向设计,可能用于神经突触或免疫突触等短暂的、动态的、易受其它研究手段干扰的细胞间相互作用系统;如果能开发出不同颜色、不同亲和力的FAP-DAPA,或许能够发展出多通道的FAP-DAPA系统,同时监测多种细胞/多种蛋白质间的相互作用,为这些体系的相互作用研究工具提供重要的改进。
来源:gh_0320d0d498b4 ACS美国化学会
原文链接:https://mp.weixin.qq.com/s?__biz=MzIyMjgzMzI0Ng==&mid=2247501646&idx=2&sn=bb17961d79076a146a702c487872827b&chksm=e825f87fdf5271697f8d8780247a433a5cb2d4bf05e5c0884edd5b1e5fc25e688b2b0d4d3bd0#rd
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
荧光蛋白的发色团及β桶结构
Adv. Mater.:经过工程改造的近红外荧光蛋白组件用于生物成像和治疗

神经环路示踪分析中更亮的荧光蛋白——HSV增亮版HBEGFP!

学术造假必遭严惩,为何仍不断有人冒险

【经典演讲】钱永健教授:荧光蛋白的发现历程

科学家利用水母荧光蛋白制造出一种新激光

NBT : 杨弋/朱麟勇团队开发Pepper拟荧光蛋白RNA
绿色荧光蛋白

人体细胞内存在“铁路”系统,能自动优化结构

“促癌黑手”Ter细胞首次发现