科技工作者之家
科界APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-04-17
来源:材料人
原标题:中科院长春应化所Adv. Mater.:经过工程改造的近红外荧光蛋白组件用于生物成像和治疗
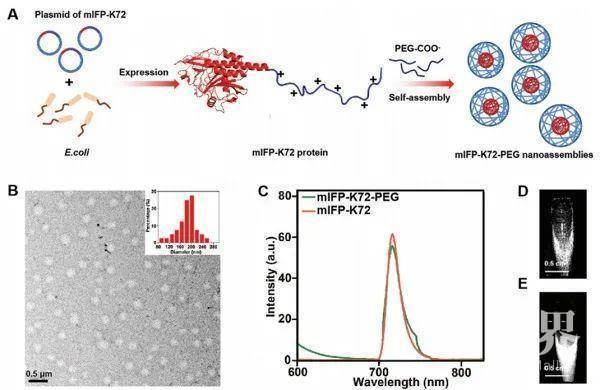 A)制造mIFP-K72-PEG组件的示意图;B)mIFP-K72-PEG的TEM图像和尺寸分布;C)mIFP-K72和mIFP-K72-PEG的发射光谱(λex= 680 nm);D,E)血液和PBS缓冲液中的荧光mIFP-K72-PEG复合物的图像。
A)制造mIFP-K72-PEG组件的示意图;B)mIFP-K72-PEG的TEM图像和尺寸分布;C)mIFP-K72和mIFP-K72-PEG的发射光谱(λex= 680 nm);D,E)血液和PBS缓冲液中的荧光mIFP-K72-PEG复合物的图像。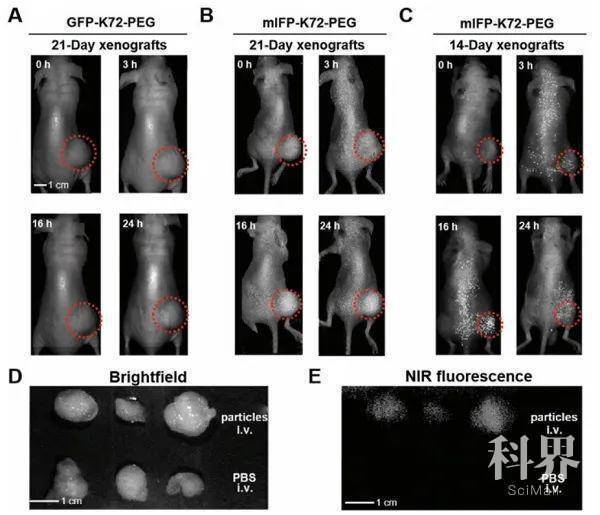 A,B)施用GFP-K72-PEG或mIFP-K72-PEG后,右后腿有肿瘤异种移植物的小鼠体内NIR荧光成像;C)体内NIR荧光成像用于在注射mIFP-K72-PEG后更早地检测肿瘤异种移植物;D,E)切除的肿瘤异种移植物的明场和NIR荧光成像。
A,B)施用GFP-K72-PEG或mIFP-K72-PEG后,右后腿有肿瘤异种移植物的小鼠体内NIR荧光成像;C)体内NIR荧光成像用于在注射mIFP-K72-PEG后更早地检测肿瘤异种移植物;D,E)切除的肿瘤异种移植物的明场和NIR荧光成像。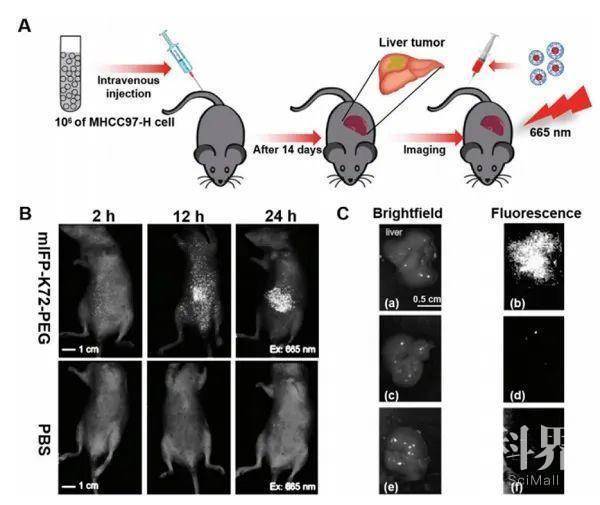 A)对小鼠转移性肿瘤结节成像的示意图;B)注射mIFP-K72-PEG后,肝脏中有转移性肿瘤结节的小鼠体内NIR荧光成像;C)来自不同组的小鼠组织的体外成像。
A)对小鼠转移性肿瘤结节成像的示意图;B)注射mIFP-K72-PEG后,肝脏中有转移性肿瘤结节的小鼠体内NIR荧光成像;C)来自不同组的小鼠组织的体外成像。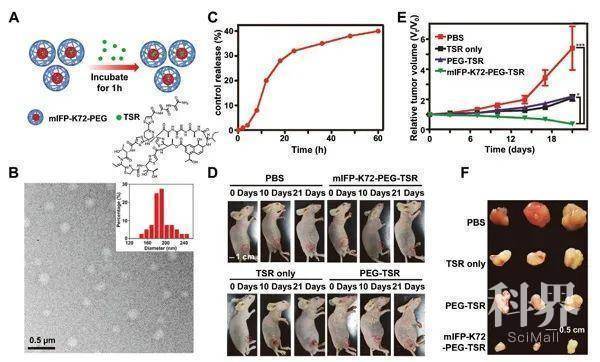 A)在mIFP-K72-PEG纳米颗粒中的TSR封装示意图;B)TSR封装的mIFP-K72-PEG纳米粒子的TEM图像和尺寸分布;C)mIFP-K72-PEG纳米颗粒中TSR的释放速率;D)用TSR封装的mIFP-K72-PEG,原始TSR,PEG-TSR和PBS治疗后右后腿有肿瘤异种移植物的小鼠的照片;E)每组治疗的肿瘤体积的调查;F)治疗21天后处死小鼠,分离所有肿瘤并捕获其大小和形态。
A)在mIFP-K72-PEG纳米颗粒中的TSR封装示意图;B)TSR封装的mIFP-K72-PEG纳米粒子的TEM图像和尺寸分布;C)mIFP-K72-PEG纳米颗粒中TSR的释放速率;D)用TSR封装的mIFP-K72-PEG,原始TSR,PEG-TSR和PBS治疗后右后腿有肿瘤异种移植物的小鼠的照片;E)每组治疗的肿瘤体积的调查;F)治疗21天后处死小鼠,分离所有肿瘤并捕获其大小和形态。来源:icailiaoren 材料人
原文链接:http://mp.weixin.qq.com/s?__biz=MjM5ODcyMzk0Mg==&mid=2651065668&idx=5&sn=362da3e9e98df6b9d6bc74868d56da92&chksm=bd36c54d8a414c5bbd967ee95306a1ee0cc8f222c8a5258e70c016f0fbcc624cf5abb26c53cf&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

中美研究人员开发出三维纳米“剪纸”结构
【经典演讲】钱永健教授:荧光蛋白的发现历程

【纳米】高度有序的荧光蛋白纳米阵列:生物启发的人工光捕获系统

合工大研发智能水凝胶,一分钟实现96%的自修复

徐涛课题组报道新型荧光蛋白
【大师讲堂】诺奖得主Martin Chalfie:绿色荧光蛋白的发展历程
华东理工大学开发拟荧光蛋白RNA ,实现荧光RNA从概念到实用的突破

【大师讲堂】诺奖得主Martin Chalfie:绿色荧光蛋白的发展历程

氨基酸和多肽可制造出具有光学活性的金纳米粒子
第一届纳米纤维素材料国际研讨会在杭州召开


