科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-08-07
来源:BioArt
责编 | 酶美
原文链接:
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652494921&idx=7&sn=a37bff7473f9003b56700d51ce77ce3a&chksm=84e24ffdb395c6ebb8f2d1be58ae3e8be79fa80a7c8ea8c5874078851a64b1e1d964ea6362e7&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
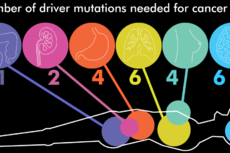
从健康细胞到癌细胞,或许只需要几个突变
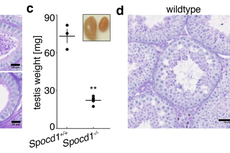
Nature | piRNA信号通路新调控因子

Science:庄小威实验室发现细胞膜相关骨架结构调节细胞信号通路的机制

我科研团队发现环形RNA调控小细胞肺癌的关键信号通路
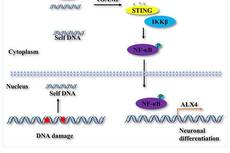
动物所发现STING信号通路对神经干细胞的调控作用

合肥研究院发现环形RNA调控小细胞肺癌的关键信号通路
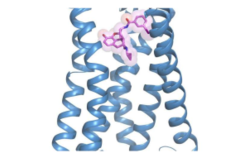
《细胞》发文!阿片类药物迎来重大突破

“促癌黑手”Ter细胞首次发现

《BLOOD》:杂志报导了慢性炎症信号导致造血干细胞衰老的关键分子通路
Hepatology: 白介素-18信号通路促进小鼠肝纤维化中肝星状细胞的激活