科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-08-09
来源:病毒学界
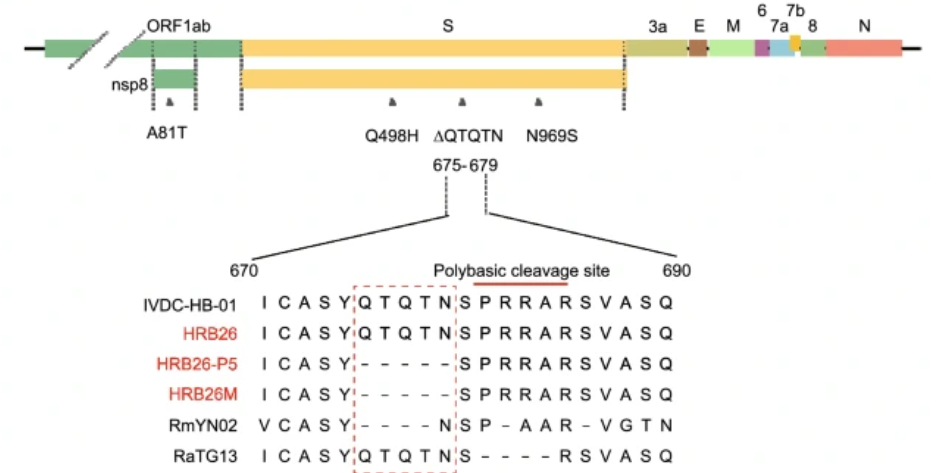
动物感染模型对SARS-CoV-2防治疫苗和药物研发及感染与免疫机制研究至关重要,尽管细胞、类器官等研发平台已经逐步成熟,然而与机体情况仍有较大差异。灵长类模型虽然能够模拟人体感染情况,但是存在周期长、操作复杂、伦理等问题,小鼠模型具有不可或缺的价值。野生型小鼠对SARS-CoV-2普遍不易感,表达SARS-CoV-2入侵细胞受体—人血管紧张素转换酶2(hACE2)转基因小鼠显著提高了SARS-CoV-2易感性,但也导致包括大脑在内的广泛组织侵噬,作为动物感染模型,与SARS-CoV-2主要感染人类呼吸系统的实际情况存在较大偏离。
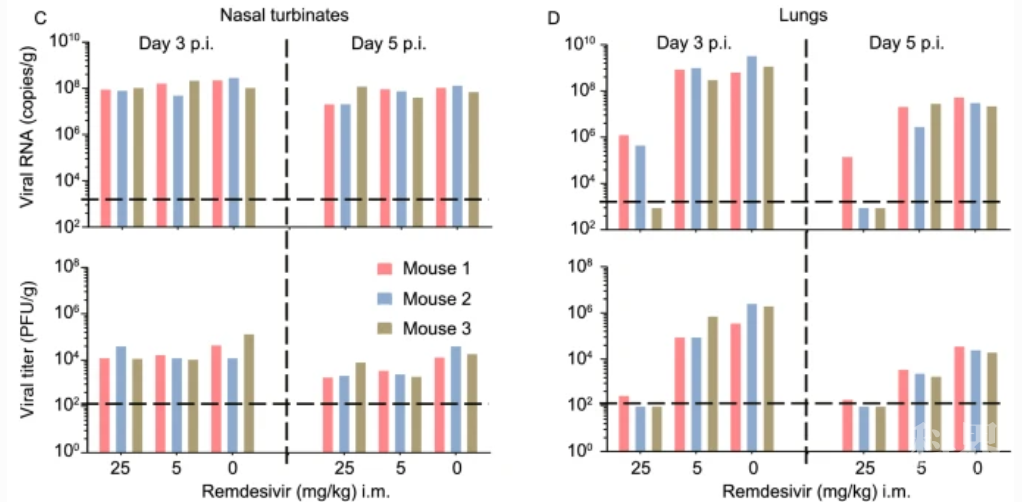
瑞德西韦疗效
该研究建立了目前唯一能同时在非转基因小鼠上呼道和下呼吸道稳定、有效复制的SARS-CoV-2感染模型。BALB/c近交系小鼠是背景最为清晰,应用最为广泛,研究最为深入的实验动物,其感染模型的建立,为COVID-19候选疫苗和抗病毒药物的大规模遴选与评价开辟了的巨大的研究资源。C57BL/6J小鼠是目前最多基因敲除的背景小鼠品系,其感染模型的建立,为更多实验室深入探索SARS-CoV-2的感染与免疫机制提供了重要手段。来源:viramedia 病毒学界
原文链接:https://mp.weixin.qq.com/s?__biz=MzIyMzQ3NTMyMQ==&mid=2247500365&idx=2&sn=a7cdc1755f3da8228263cee84426448e&chksm=e81f215bdf68a84d78acf64ea8df1cfa2c912e70fcf430091ba39aa9026e587d3e04c7c2de2c#rd
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

SARS治愈者的抗体可以抑制SARS-CoV-2 |《自然-免疫》论文

《Nature》子刊:为SARS-CoV-2归类

Nature又一个里程碑:小鼠SARS-CoV-2模型

通过模型估算SARS-CoV-2的传播时间点 |《自然-医学》论文
SARS-CoV-2微型抑制蛋白的全新设计
SARS-CoV-2的进化:从动物到人类路径

SARS-CoV-2能够感染肠细胞 |《自然-医学》论文

大赛预告丨第二届Byte Cup来袭,赢得2万美元奖金,登上字节跳动面试直通车

干货 | 深度学习模型超参数搜索实用指南

CICC科普栏目|嘿嘿,想变成会跳舞的小哥哥或小姐姐吗?超简单!