科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-11-16
来源:中国生物技术网
编译:朱妙淳 周翠怡 魏韬 (华南农业大学食品学院)
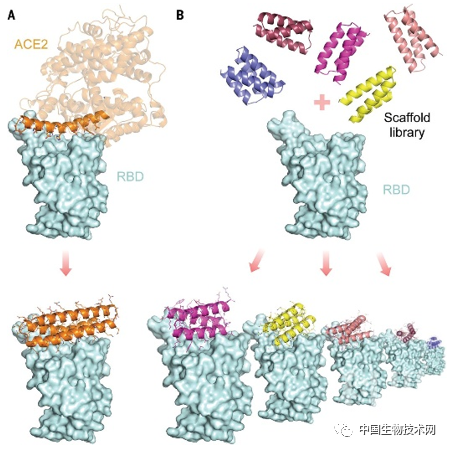
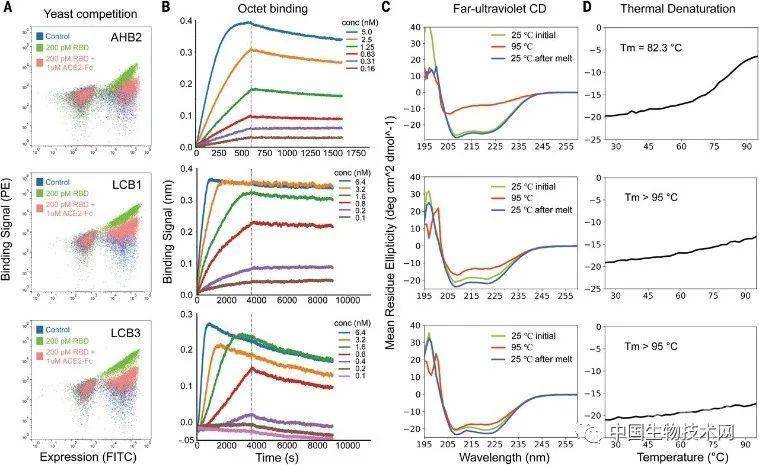
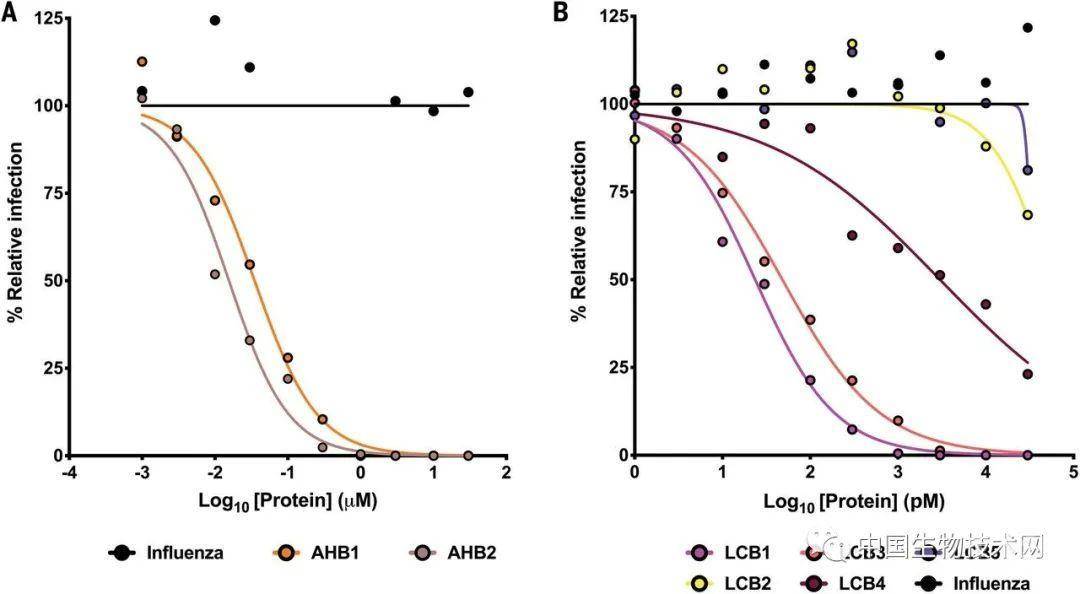
来源:biotech-china 中国生物技术网
原文链接:http://mp.weixin.qq.com/s?__biz=MjM5ODU5NDgyMg==&mid=2653957217&idx=6&sn=9ff13c00007f1182cc3d58aebec22f85
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
新型冠状病毒感染的肺炎护理要点

孙悟空飞进铁扇公主嘴里后都看到了什么?

Environ Int:家庭清洗剂的使用和呼吸道与过敏症状研究

【有益思】移动闪存盘 摄像头 当心日常设备被攻击

当心呼吸道感染恢复期症状反复

【全国科普日专题】HPV疫苗相关问题

Nature:全文编译!复旦张永振组揭示新型冠状病毒与中国正爆发的呼吸道疾病有关
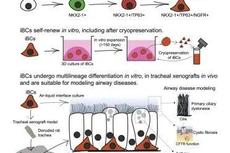
血细胞变呼吸道细胞,加速COVID-19等呼吸道疾病研究

医院厕所的喷气式干手机你还敢用吗?
下呼吸道组成