科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-08-12
来源:中国科学院微生物研究所
肠道微生物组是人体“第二基因组”,其编码的基因及产物在人体生长、发育,免疫、代谢稳态维持过程中发挥重要作用。肠道微生物数量巨大,物种多样性丰富,包括有益菌和有害菌。如何快速准确的找到肠道菌群中参与人体调节的关键“先生”并阐明其作用机制,是肠道微生物组研究的前沿科学问题。
中国科学院微生物研究所刘宏伟研究员团队与刘双江研究员团队紧密合作,提出挖掘关键、核心肠道微生物的新策略。采用益生元、难吸收药物等外源分子(Outsidedisturbance factors)干预机体,扰动肠道菌群结构和组成,寻找丰度显著变化OTU,将其定义为内在效应菌(Insideeffectors),进一步阐明效应菌功能和机制(图1)。
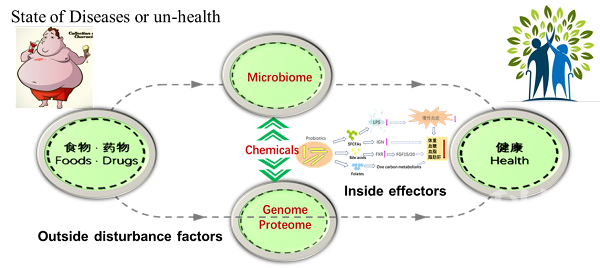
图1 挖掘关键、核心肠道微生物的新策略
前期研究中发现灵芝来源的小分子通过靶向调节肠道菌群的组成、结构,重建健康肠道菌群,发挥减肥、降糖、降脂作用(J. Med. Chem.,2018)。通过培养组比较给药前后小鼠肠道微生物组变化,获得一株给药后显著增加的肠道狄氏副拟杆菌(Nat. Commun.2020)。
口服狄氏副拟杆菌显示良好的减肥、降糖、降脂作用。作用机制研究表明:该菌将初级胆酸转化为熊去氧胆酸、石胆酸等次级胆酸,激活次级胆酸介导的肠肝轴途径,发挥降脂作用;通过合成琥珀酸促进肠道糖新生途径,激活肠脑轴通路,发挥减肥和降糖作用(Cell Rep.2019,图2)。
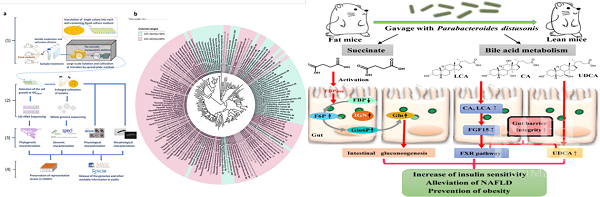
图2 小鼠肠道微生物库及狄氏副拟杆菌降脂、降糖机制
团队利用fa/fa大鼠作为脂肪肝动物模型,研究了口服难吸收灵芝杂萜抗非酒精性脂肪肝作用。灵芝杂萜抑制肝脏脂肪从头合成、促进脂肪酸氧化和低密度脂蛋白运输,抗脂肪肝作用明显。16S测序表明化合物显著富集了具有产叶酸能力的拟杆菌(Bacteroides.spp)和产丁酸的Kineothrix alysoides;KEGG分析显示叶酸(维生素B9)合成及其调控的一碳代谢通路显著增强。
通过对B. thetaiotaomicron,B. acidifaciens, B. dorei, and B. uniformi基因组分析发现这四种显著富集的拟杆菌含有完整的叶酸合成途径,但缺失叶酸合成前体pABA的aroD基因。体外添加pABA证实它们可以高效合成叶酸。
肠道菌群来源叶酸已经被证实是低碳饮食改善脂肪肝的重要机制(Cell Metab.,2018, 559),但参与叶酸-肝脏通路调节的肠道微生物还缺乏研究。
选取化合物干预后增加最显著的解木糖拟杆菌(B.xylanisolvens)深入研究,口服解木糖拟杆菌BX显著增加肝脏、血液中叶酸含量,提高叶酸调控的一碳代谢,显示良好的降脂、降糖、抗脂肪肝作用。敲除叶酸生物合成途径folP基因,获得叶酸合成缺陷株BXΔfolP。体内实验显示BXΔfolP无抗脂肪肝作用(图3)。
该研究首次证明了肠道拟杆菌-叶酸-肝脏途径在治疗脂肪肝等代谢疾病方面的巨大潜力。研究组利用人体肠道来源的解木糖拟杆菌研制了酸奶产品(图3)。
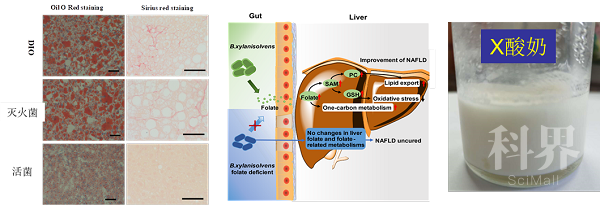
图3 解木糖拟杆菌降低脂肪肝作用与肠道叶酸调控的作用机制
以上研究成果以“Activationof a specific gut Bacteroides-folate-liver axis benefits for the alleviation ofnonalcoholic fatty liver disease”为题在线发表在国际著名学术刊物Cell Reports上。
微生物所刘宏伟研究员课题组乔姗姗、宝丽副研究员、汪锴博士为该论文的共同第一作者,刘宏伟研究员、刘双江研究员为论文共同通讯作者。该工作得到了陈义华研究员团队、微生物资源与大数据中心的支持和帮助。
刘宏伟研究员、刘双江研究员团队在微生物组研究方面取得了系列研究成果,发表研究论文5篇,包含ESI高被引论文一篇;申请中国发明专利两项,充分体现了中科院微生物研究所学科综合优势。
感谢中国科学院战略生物资源服务网络计划评价转化平台项目(ZSTH-016)、中国科学院重点部署项目 “人体与环境健康的微生物组共性技术研究”(KFZD-SW-219)、中国科学院B类先导项目“肠道微生物分析技术与标准化系统研究”(XDB38020300)、国家自然科学基金 (81773614)和中国科学院青年创新促进会项目 (2014074)等的资助。
发表研究论文:
Shanshan Qiao, Li Bao, Kai Wang, Shanshan Sun, Mingfang Liao,Chang Liu, Nan Zhou, Ke Ma, Yuwei Zhang, Yihua Chen, Shuang-Jiang Liu*, HongweiLiu.* Activation of a specificgut Bacteroides-folate-liver axis benefits for the alleviation of nonalcoholichepatic steatosis. Cell Reports, 2020, accepted.
ChangLiu, Nan Zhou, Mengxuan Du, Yutong Sun, Kai Wang, Yujing Wang, Danhua Li,Haiying Yu, Yuqin Song, Bingbing Bai, Yuhua Xin, Linhuan Wu, Chengying Jiang,Jie Feng, Hua Xiang, Yuguang Zhou, Juncai Ma, Jun Wang, Hongwei Liu,* Shuangjiang Liu.* Mouse gut microbial biobank (mGMB) revealsdiverse novel culture bacteria.Nature Communication, 2020, doi.org/10.1038/s41467-019-13836-5.
Kai Wang, Mingfang Liao, Nan Zhou, Li Bao, Ke Ma,Zhongyong Zheng, Yujing Wang, Chang Liu, Wenzhao Wang, Jun Wang, Shuangjiang Liu*, Hongwei Liu*. Parabacteroides distasonis alleviatesobesity and metabolic dysfunctions via production of succinate and secondarybile acids. Cell Reports, 2019, 26, 222-235(ESI高被引论文).
KaiWang#, Li Bao#, Nan Zhou, Jinjin Zhang, Mingfang Liao, Zhongyong Zheng, YutingZhang, Chang Liu, Jun Wang, Lifeng Wang, Wenzhao Wang, Shuangjiang Liu, HongweiLiu*. Structural modification of natural productganomycin I leading to discovery of a a-glucosidase and HMG-CoA reductase dualinhibitor improving obesity and metabolit dysfunction in vivo. Journalof Medicinal Chemistry, 2018, 61, 3609-3625.
来源:IMCAS1958 中国科学院微生物研究所
原文链接:http://mp.weixin.qq.com/s?__biz=MzA4NDc5NjM5NA==&mid=2651460164&idx=1&sn=c9c9428b6e155c0f8cd81d18141d6a7b&chksm=841f04c1b3688dd7beb1b86015f4e27cdd890e92ccbb41b8929e3b099f20e1e2b4460ae756a4&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

阳光照射可改变肠道微生物菌群
微生物所肠道解木糖拟杆菌抗脂肪肝机制研究获进展
疾病: 了解风湿性关节炎的发病机制

我国最大乳酸菌种资源库建成
牢记这些“肝”货,远离脂肪肝
脂肪肝不是病?为你细数脂肪肝的“三大罪状”
宇航员首次在太空中鉴定未知微生物

肠道微生物影响记忆?今日《自然》揭示菌群变化如何改变大脑
新突破:肠道微生物菌群可用于诊断肝脏疾病

人体肠道菌群与恶性肿瘤:肠道微生物群调节影响化疗药物的疗效和毒性(三)