科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-08-19
来源:精准医学与蛋白组学
肿瘤转移是乳腺癌患者死亡的主要原因之一,成功治疗转移性乳腺癌是目前实体肿瘤学的主要临床挑战。肿瘤转移包括肿瘤细胞从原发部位侵入周围组织、外渗到继发部位等,是极其复杂的过程。在乳腺癌亚型中,人表皮生长因子受体2 (HER2)阳性和三阴性乳腺癌(TNBC)具有侵袭性和易于转移的特点,与其他亚型相比,这两个亚型的患者复发率较高,生存率较低。若能更好地了解促进转移的分子机制,将有助于开发新的抗转移疗法,以改善对转移性乳腺癌的治疗效果。
研究速读
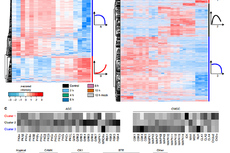
1. TNBC模型中酪氨酸激酶受体AXL相关磷酸化组学分析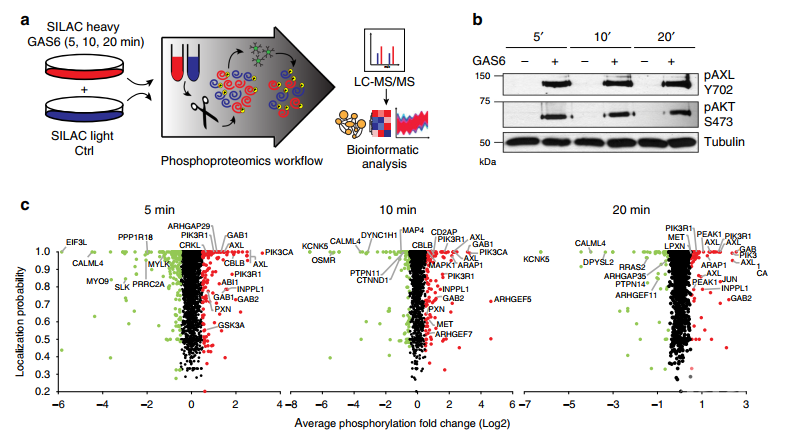
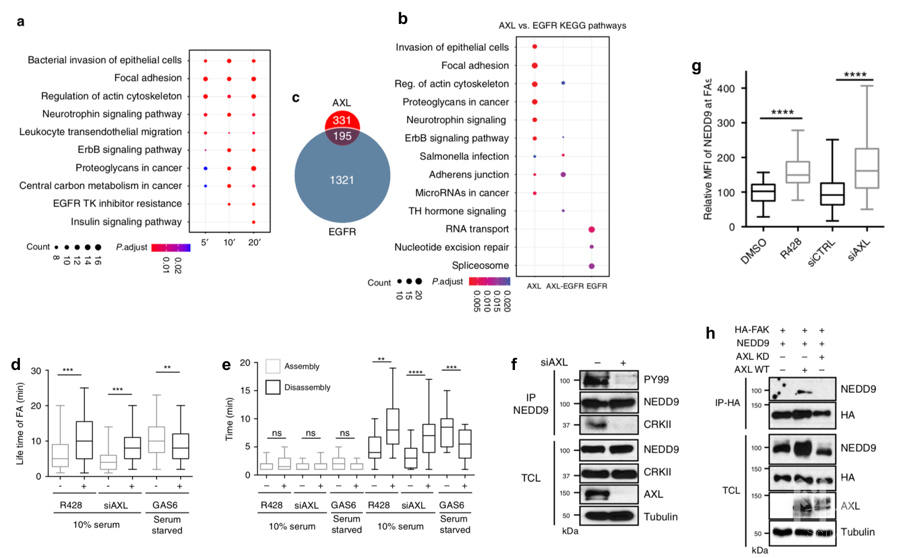
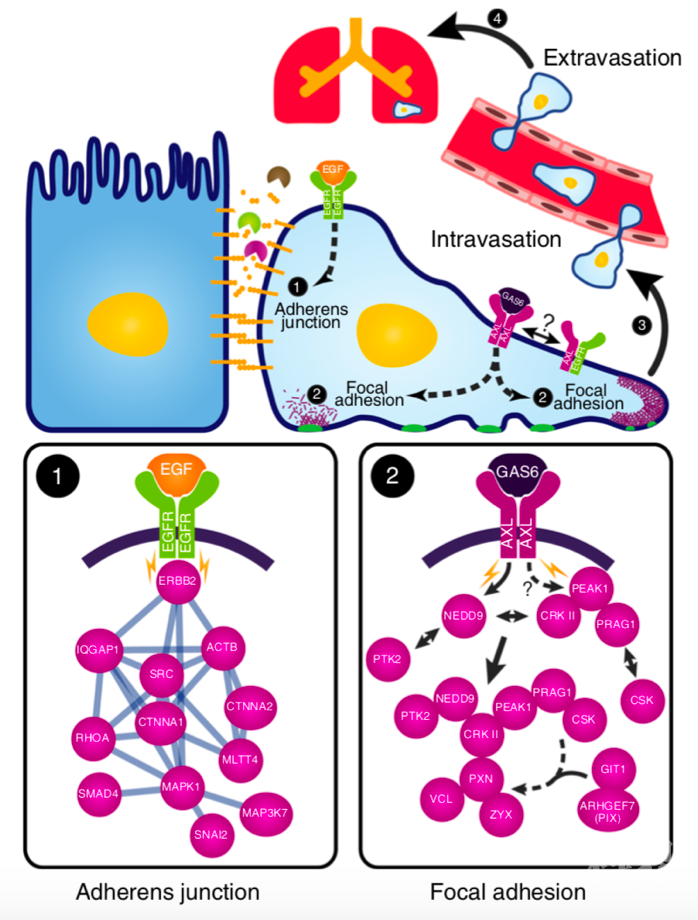
总 结
此前的研究对AXL信号参与的肿瘤侵袭机制缺乏很好的解释,本文通过磷酸化蛋白组学的深入分析,揭示了AXL信号通路对FA动态稳定的调控,阐述了长期以来备受关注的AXL转移活性机制,并确定了PEAK1作为AXL阳性肿瘤的治疗靶点。文章凸显出蛋白翻译后修饰在临床医学中的重要研究意义,而修饰蛋白组学则为蛋白质的翻译后修饰研究提供了保障。来源:ptm-biolab 精准医学与蛋白组学
原文链接:https://mp.weixin.qq.com/s?__biz=MjM5NDM5NjQxOA==&mid=2650449191&idx=1&sn=2e997951ae318168e269b4ad1676983a&chksm=be86654a89f1ec5cd3187bd0daeb5b2e90bce95837852a24af301480c5e3f4fdec7533b67a23#rd
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
乳腺癌个体化诊疗的基础和临床研究

什么是乳腺癌?

战胜柯洁后,DeepMind试图用人工智能战胜乳腺癌
【科普】预防乳腺增生,远离乳腺癌

【前沿】MIT新开发的 AI 模型有望改进恶性脑瘤治疗

绘制拟南芥转录组、蛋白质组和磷酸化修饰组图谱,蛋白质丰度与翻译后修饰等研究

乳腺癌防治月 | 关注乳腺健康

化学小分子诱导靶标蛋白质去磷酸化
蛋白质组学和磷酸化修饰组学揭示肠道病毒感染宿主的动态调控

一种氨基酸水平影响乳腺癌扩散