科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-08-20
来源:BioArt
Epacadostat——吲哚胺-2,3-双加氧酶1(IDO1)的选择性抑制剂;pembrolizumab(也称Keytruda,K药)——PD-1抑制剂。两者的联用曾在晚期黑色素瘤的1-2期临床试验中表现出极具前景的抗肿瘤活性,然而,它们联用的3期临床试验却失败了【1】。原因却未知。
联合治疗无疑将成为免疫疗法未来发展的必然趋势。那么,为什么要将上述两种药进行联用呢?
IDO1/2或者色氨酸-2,3-双加氧酶(TDO2)所启动的犬尿素途径是人类细胞主要的色氨酸(Trp)分解代谢途径,可以产生芳烃受体(AHR)激动剂犬尿氨酸(Kyn)和犬尿喹啉酸(KynA)。AHR是一种配体激活的转录因子,它能使细胞通过感知来自环境、饮食、微生物和细胞代谢的化合物来适应不断变化的环境【2】。与配体结合后,AHR转运到细胞核,在那里与ARNT形成异二聚体,并通过与外源反应元件(XRE)结合来诱导转录【3】。AHR的靶点可以调节多种生物过程,包括血管生成、造血、药物和脂质代谢、细胞运动和免疫调节,在发育、免疫和癌症等过程中都发挥着重要作用。除了外源物质,来自植物、微生物或内源性代谢产物等的天然的配体也可以成为AHR的有效激动剂,而Trp代谢产物Kyn和KynA就是这样一类重要的内源性AHR配体【4】。
癌细胞通常表达高水平的IDO1和TDO2,以更好地利用Trp分解代谢介导的AHR激活途径。Kyn-AHR信号通路可以增强癌细胞的恶性表型,尤其是增强癌细胞活性。此外,Kyn-AHR信号通路也被认为可以通过诱导以下过程来抑制T细胞的增殖和功能:1)调节性T细胞(Treg)分化【5】;2)CD8+ T细胞上程序性细胞死亡蛋白1(PD1)的表达【6】;3)CD8+ T细胞的细胞死亡【7】;4)免疫抑制肿瘤相关巨噬细胞的募集【8】。由此可见,抑制Trp分解代谢酶(TCE)可以成为一种很有前途的既能靶向抑制癌细胞恶性程度、也能靶向治疗肿瘤免疫抑制的策略。因此,也就出现了开篇所述的IDO1小分子抑制剂作为免疫检查点阻断(ICB)药物的辅助物而联用的临床试验。然而3期临床试验的失败,虽然其部分原因可能是由于缺乏基于IDO1表达水平的患者分层,却也给予我们警醒——Trp分解代谢在癌症中的作用远不止我们现在所知道的,激活AHR的其他途径也有可能影响IDO1抑制剂的作用,对其进行深入的理解或将能为免疫治疗提供新机会。
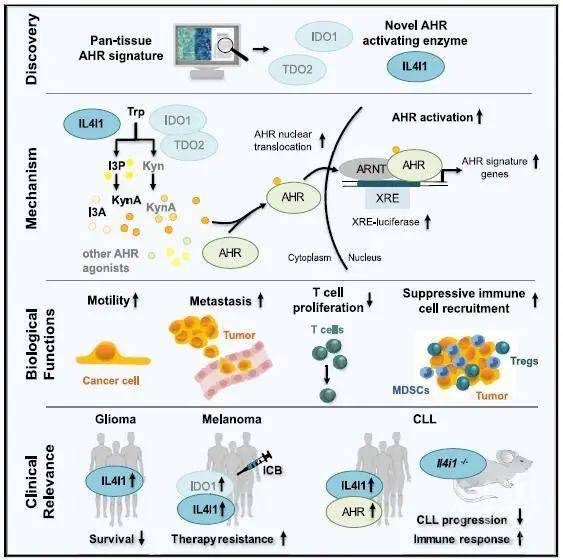
基于以上,2020年8月19日,来自德国癌症研究中心的Christiane A. Opitz研究团队在Cell上在线发表文章 IL4I1 Is a Metabolic Immune Checkpoint that Activates the AHR and Promotes Tumor Progression ,利用一种泛组织AHR特征信号,在32个实体肿瘤中,揭示了白介素-4-诱导-1(IL4I1)是比IDO1或TDO2更频繁地与AHR活性相关的分子,其可以通过产生吲哚代谢物和KynA来激活AHR。而ICB治疗可诱导AHR激活酶IL4I1的活性,并通过其对适应性免疫的抑制作用来促进肿瘤进展,由此解释了ICB和IDO1抑制剂联用的临床试验失败的可能原因,为癌症治疗打开了新世界的大门。

为了寻找人类肿瘤中激活AHR的新介质,本文的研究人员将基因表达分析和自然语言处理(NLP)相结合,开发了一个泛组织AHR特征信号以检测多个AHR配体和不同细胞类型对AHR活性的影响(图1)。出人意料的是,分析研究发现在人类肿瘤中,AHR活性与L-氨基酸氧化酶IL4I1(已知主要催化苯丙氨酸Phe氧化脱氨生成苯丙酮酸PP,同时生成H2O2和NH3)的关联比其他任何一种TCE(包括已知的AHR激活因子IDO1和TDO2)的关联都更强。
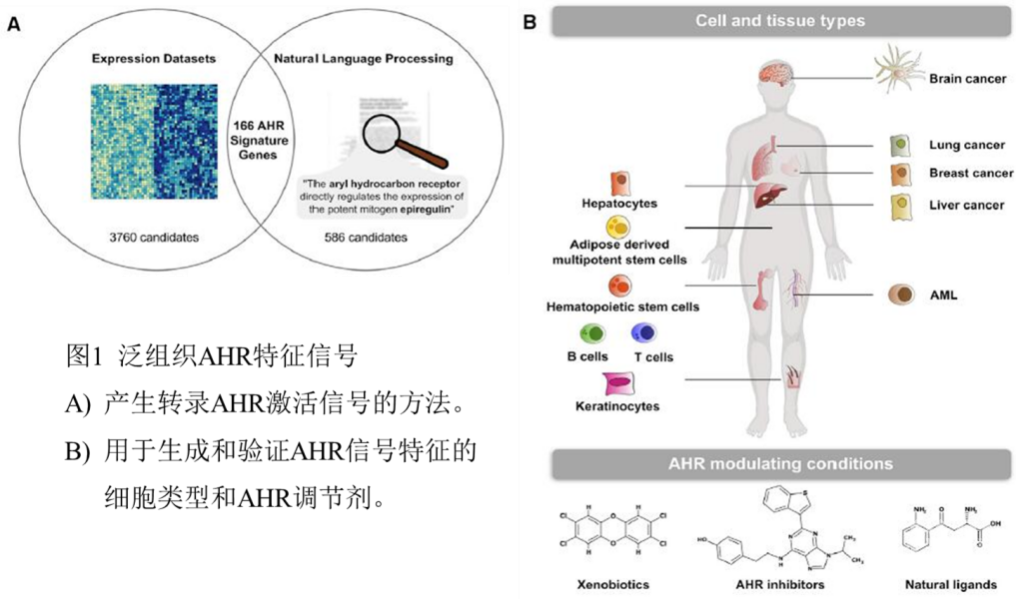
在恶性胶质瘤(GBM)细胞中异位表达IL4I1,AHR特征信号增强,IL4I1来源的代谢物则增加了AHR的核定位及其下游靶基因转录,从而激活AHR。而IL4I1的表达下调则呈现相反的结果。值得注意的是,在AHR敲低时,IL4I1的表达也减少了,表明IL4I1本身也是AHR的靶基因。而在低表达IDO1的CAS-1细胞中,研究也证实了IL4I1介导的AHR调节效应是独立于TDO2的,由此证明IL4I1是更有效的AHR激活酶。
进一步地,研究人员开始探索IL4I1对AHR功能的影响。研究表明IL4I1可以促进肿瘤细胞的运动能力,抑制外周血单核细胞(PBMC)中T细胞和分离的CD8+ T细胞的增殖。同时,研究发现,高IL4I1水平与胶质瘤病人(包括恶性与早期患者)的总生存率降低密切相关。而IL4I1高表达的胶质瘤病人组均表现出较高的AHR活性,证实了IL4I1与胶质瘤AHR活性和生存结果密切相关。
那么,IL4I1到底是通过哪种代谢产物激活AHR的呢?研究发现,IL4I1可以分别将细胞培养基中的Phe、酪氨酸(Tyr)和Trp转变为PP、羟基苯丙酮酸(HPP)和吲哚-3-丙酮酸(I3P)。而只有I3P可以在多种细胞类型中以一种AHR依赖方式显著上调AHR靶基因的表达,并且诱导AHR的入核及XRE驱动活性,且所需浓度远低于已知的AHR激活剂Kyn和KynA。同时,I3P以一种AHR依赖性方式增加GBM细胞的运动性,激活CD8+ T细胞中的AHR,从而抑制T细胞增殖,而这是通过I3P代谢产物KynA和吲哚-3-乙醛(I3A)实现的。由此证实,I3P作为一种新的单体代谢物,介导了IL4I1和AHR驱动的肿瘤恶性特征。
研究人员发现,与正常组织相比,在大多数肿瘤中,IL4I1在原发癌组织中表达增强,在弥漫性大B细胞淋巴瘤中表达最强。与原位癌相比,IL4I1水平和AHR活性在转移癌中增强。同时,在大多数肿瘤中,IL4I1的表达高于IDO1或TDO2,突出显示IL4I1是肿瘤中主要的TCE,并且其可以在低氧肿瘤微环境(TME)中激活AHR。在IL4I1高表达的肿瘤中,抑制性免疫细胞如骨髓来源的抑制细胞(MDSC)和Treg富集。采用类似侵袭性慢性粒细胞白血病(CLL)的动物模型TCL1 AT小鼠进行研究,证实了IL4I1在肿瘤免疫逃逸中起着重要作用,TEM中IL4I1的缺失可以减缓CD8+ 效应T细胞的衰减,PD1介导的CD8+ T细胞功能增强,从而表明IL4I1是一个抑制适应性免疫反应的代谢免疫检查点。
最后,让我们回归开篇的问题,IDO1抑制剂和ICB药物的联用的3期临床试验为什么会失败?本文的研究人员发现,由于IL4I1的免疫抑制作用,它可以规避对ICB药物的应答。同时,ICB药物可以诱导IL4I1的水平和AHR活性增加,从而使癌细胞对ICB产生抵抗。而IDO1抑制剂对IL4I1酶活性并没有影响,因此IL4I1可以介导癌细胞在ICB背景之下的IDO1抑制剂抵抗。通过激活AHR,IL4I1表现出了一种针对ICB和/或IDO1抑制剂的代谢抵抗机制,这大概就是失败的原因之一吧。或许将IL4I1作为一个新的肿瘤治疗靶点可以解决这一问题,值得一提的是,本文提供的泛组织AHR特征信号的利用,也将有助于筛选适用于靶向TCE或AHR活性治疗的病人。
参考文献(向上滑动阅览)
1. Long, G.V., Dummer, R., Hamid, O., Gajewski, T.F., Caglevic, C., Dalle, S., Arance, A., Carlino, M.S., Grob, J.J., Kim, T.M., et al. (2019). Epacadostat plus pembrolizumab versus placebo plus pembrolizumab in patients with unresectable or metastatic melanoma (ECHO-301/KEYNOTE-252): a phase 3, randomised, double-blind study. Lancet Oncol. 20, 1083–1097.
2. Rothhammer, V., and Quintana, F.J. (2019). The aryl hydrocarbon receptor: an environmental sensor integrating immune responses in health and disease. Nat. Rev. Immunol. 19, 184–197.
3. Nguyen, L.P., and Bradfield, C.A. (2008). The search for endogenous activators of the aryl hydrocarbon receptor. Chem. Res. Toxicol. 21, 102–116.
4. Denison, M.S., and Nagy, S.R. (2003). Activation of the aryl hydrocarbon receptor by structurally diverse exogenous and endogenous chemicals. Annu. Rev. Pharmacol. Toxicol. 43, 309–334.
5. Mezrich, J.D., Fechner, J.H., Zhang, X., Johnson, B.P., Burlingham, W.J., and Bradfield, C.A. (2010). An interaction between kynurenine and the aryl hydrocarbon receptor can generate regulatory T cells. J. Immunol. 185, 3190–3198.
6. Liu, Y., Liang, X., Dong, W., Fang, Y., Lv, J., Zhang, T., Fiskesund, R., Xie, J., Liu, J., Yin, X., et al. (2018). Tumor-Repopulating Cells Induce PD-1 Expression in CD8+ T Cells by Transferring Kynurenine and AhR Activation. Cancer Cell 33, 480–494.
7. Greene, L.I., Bruno, T.C., Christenson, J.L., D’Alessandro, A., Culp-Hill, R. Torkko, K., Borges, V.F., Slansky, J.E., and Richer, J.K. (2019). A role for tryptophan- 2,3-dioxygenase in CD8 T-cell suppression and evidence of tryptophan catabolism in breast cancer patient plasma. Mol. Cancer Res. 17, 131–139.
8. Takenaka, M.C., Gabriely, G., Rothhammer, V., Mascanfroni, I.D., Wheeler, M.A., Chao, C.C., Gutie´ rrez-Va´ zquez, C., Kenison, J., Tjon, E.C., Barroso, A., et al. (2019). Control of tumor-associated macrophages and T cells in glioblastoma via AHR and CD39. Nat. Neurosci. 22, 729–740.
来源:BioGossip BioArt
原文链接:https://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652496667&idx=4&sn=96d22ab608deffd34d2f537adb92b05b&chksm=84e270afb395f9b9a0f10c2105a5fce9f100ee4f2e9e192c097c044655e5726a56d80c515e21#rd
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

关注 | 119种药品新纳入医保!含治疗新冠肺炎药品
2016药物/化学品致癌性试验研究高级培训班在青岛举行

119种药品新纳入医保!含治疗新冠肺炎药品
夏季太阳毒,小心“日光性皮炎”!

药品有效期≠使用期,这些药品安全常识你应该知道

国家医保局:新增111个药品进入医保药品目录

药品安全红色领航2021年“药品科技活动周”在京启动

这类药品停产!禁售!

首批鼓励仿制药品目录公布,33种药品入选!

我市调整职工慢性病药品目录涉及药品137种