科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-03-24
大脑的学习和记忆是一种高度协调的精细过程,突触囊泡运载神经递质等化学物质,将突触信息从一个神经元传递给下一个神经元,以此完成神经元之间的信息交流。突触分泌过程中膜融合和相关大分子调控的机制是近年来该领域的热点问题。
突触分泌中膜融合的过程高度依赖SNARE蛋白(Syntaxin-1、SNAP-25和Synaptobrevin-2) 从N端到C端以“拉链”形式组装成反式SNARE复合物,进而将突触囊泡和质膜拉近来完成膜融合【1】。这一过程受到突触前膜生物大分子高度调控。CAPS (Calcium-dependent secretion activator)和Munc13家族蛋白在突触囊泡 (synaptic vesicle,SV) 和致密核心囊泡(dense core vesicle,DCV)的胞吐分泌中起着重要的调控作用【2-5】。研究表明,Munc13-1蛋白能通过“MUN”功能区激活Syntaxin-1蛋白【6-7】,进而启动SNARE复合物的组装,从而促进胞吐分泌的发生。相对而言,CAPS-1蛋白在突触分泌中的机制一直不清楚。
3月19日, 华中科技大学生命科学与技术学院的马聪教授课题组在Cell Reports上在线发表了题为 Structural and Functional Analysis of the CAPS SNARE-Binding Domain Required for SNARE Complex Formation and Exocytosis的研究论文。文章报道了CAPS-1和Munc13-1通过协同调控SNARE复合物组装的作用模式,从而时序性调控突触分泌的过程。

研究发现, CAPS-1蛋白的DAMH功能区(和Munc13-1 MUN功能区存在结构相似性)不具备激活Syntaxin-1蛋白的功能;相反,它通过与Munc13-1 MUN结合,强烈抑制Munc13-1激活Syntaxin-1的能力,这一功能可以在突触分泌初期有效控制Munc13-1活性并保证突触囊泡在突触前膜的有效富集。在Syntaxin-1被激活后,CAPS-1又能持续稳定Syntaxin-1的激活状态,进而加速SNARE复合物的组装, 并最终促进突触分泌过程的发生。
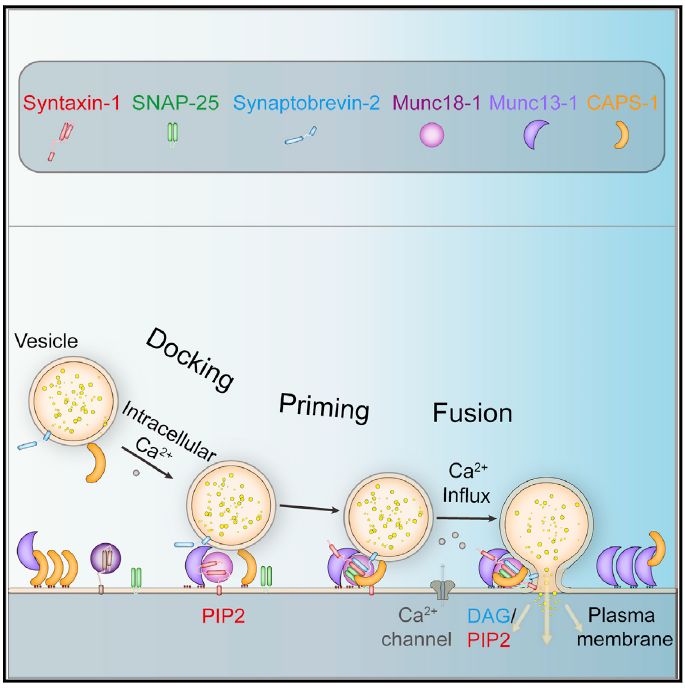
此项研究成果拓展了马聪教授课题组在神经递质分泌机制领域的观点【6-9】。在分子水平上揭示了CAPS-1和Mun13-1蛋白在胞吐分泌过程中功能关系,提出在胞吐分泌过程中CAPS-1蛋白主要依赖与Munc13-1和SNARE蛋白时序性的协同互作来完整的发挥功能。文章阐明了CAPS与Munc13家族蛋白在SNARE蛋白介导的突触分泌中的分子机制和其在突触分泌中的重要作用。
原文链接:
https://doi.org/10.1016/j.celrep.2019.02.064
参考文献
1. Jahn, R. and R.H. Scheller, SNAREs--engines for membrane fusion. Nat Rev Mol Cell Biol, 2006. 7(9): p. 631-43.
2. van de Bospoort, R., et al., Munc13 controls the location and efficiency of dense-core vesicle release in neurons. J Cell Biol, 2012. 199(6): p. 883-91.
3. Imig, C., et al., The morphological and molecular nature of synaptic vesicle priming at presynaptic active zones. Neuron, 2014. 84(2): p. 416-31.
4. Speidel, D., et al., CAPS1 regulates catecholamine loading of large dense-core vesicles. Neuron, 2005. 46(1): p. 75-88.
5. Jockusch, W.J., et al., CAPS-1 and CAPS-2 are essential synaptic vesicle priming proteins. Cell, 2007. 131(4): p. 796-808.
6. Ma, C., et al., Reconstitution of the vital functions of Munc18 and Munc13 in neurotransmitter release. Science, 2013. 339(6118): p. 421-5.
7. Yang, X., et al., Syntaxin opening by the MUN domain underlies the function of Munc13 in synaptic-vesicle priming. Nat Struct Mol Biol, 2015. 22(7): p. 547-54.
8. Wang, S., et al., Conformational change of syntaxin linker region induced by Munc13s initiates SNARE complex formation in synaptic exocytosis. EMBO J, 2017. 36(6): p. 816-829.
9. Wang, S., et al., Munc18 and Munc13 serve as a functional template to orchestrate neuronal SNARE complex assembly. Nat Commun, 2019. 10(1): p. 69.
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652467917&idx=4&sn=5fc0b3950e59810ad26e69f1b8e19bc8&chksm=84e2e179b395686fe3d20c4740d4be4ca7412a45349e85e60fd03b3e28b1aa418169d2e7642f&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

Neuron : 可变剪接对于不同突触传递的影响
陈晓伟团队揭示一条受体介导的脂蛋白分泌通路可高效特异地调控血脂稳态
泪液分泌型免疫球蛋白A

JNS:复旦薛磊团队揭示BDNF在兴奋性突触传递中的逆向调控机制
Molecular Plant 出版“植物激素”专辑
Hans Clevers团队揭示人肠内分泌细胞mRNA和分泌蛋白质组图谱
层状氮化物MNCl (M: Hf, Zr)中电场诱导的稳态超导电性
莘雯博士等揭示少突胶质细胞在调节谷氨酸突触传递中的功能

研究发现谷氨酸受体信号肽在神经突触信息传递中的新功能
Plant Cell | KOR1蛋白分泌途径和耐盐功能的调控机制