科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-03-29
细胞之间的连接与交流是生物有机体维持正常生理功能的必要环节。Connexin与Pannexin家族是形成细胞之间连接的重要离子通道,它们控制的信号通路在细胞正常生理作用中发挥关键的作用。Connexin(Cx)家族包括21个成员,其中一些成员发生突变已被发现引起诸多疾病。例如,Cx32突变导致神经系统疾病Charcot-Marie-Tooth(Science,1993)【1】, Cx26,Cx31,Cx30突变导致听力障碍(Nature, 1997;Nature Genetics,1998;Nature Genetics, 1999)【2-6】,Cx46突变致白内障(Am J Hum Genet,1999)【7】等。Pannnexin(PANX)家族由三个成员PANX1,2,3组成。迄今尚未发现任何疾病由此三个成员突变导致。PANX1在2003年被克隆, 随后的十余年间,大量研究报道其与炎症、感染、局部缺血等生理病理学过程有关,但是,未有PANX1突变引起人类疾病的报道。PANX1敲除鼠可育,也不存在其他器官的明显异常。这些证据似乎又表明PANX1并不重要。
2019年3月27日, 复旦大学王磊、桑庆团队,联合上海交通大学附属第九人民医院生殖中心匡延平团队在Science Translational Medicine发表了题为A Pannexin 1 Channelopathy Causes Human Oocyte Death的最新研究成果。首次发现了一种全新的临床疾病,将其命名为“卵子死亡”。在四个独立家系中,发现了细胞连接蛋白家族成员PANX1存在不同的突变, 通过细胞水平、爪蟾卵子、鼠模型等多个角度深入揭示了致病机制:突变通过影响蛋白糖基化、激活通道、加速ATP释放,致表型出现,从而证明了卵子死亡是一种全新的孟德尔遗传病及糖基化疾病,也是PANX家族成员异常的首个离子通道疾病。

研究首先发现了一种此前从未被报道过的,导致女性不孕及试管婴儿反复失败的全新临床表型:某些患者卵子取出体外放置一段时间或受精后一段时间,出现退化凋亡的现象,将其命名为“卵子死亡” (图1A)。在四个独立家系中,发现了PANX1存在不同的突变 (图1B), 明确了此表型符合孟德尔显性遗传特点,证明了卵子死亡是一种全新的孟德尔显性遗传病。
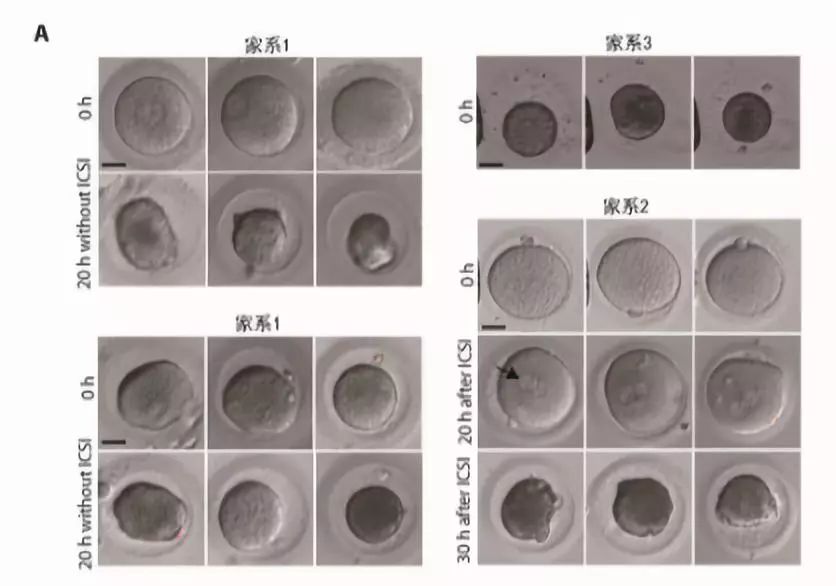
图1
PANX1为糖基化蛋白,随后在细胞及卵子中的系列功能实验证明:突变会改变PANX1的糖基化模式,被改变的糖基化模式与疾病密切相关,表明卵子死亡亦属于一种新的糖基化疾病。通过体外鼠卵子、爪蟾卵子研究显示:突变引起PANX1通道异常激活,加速了卵子内部ATP释放,导致疾病出现。有趣的是,四个PANX1 点突变鼠的生育力均正常且无明显表型。随后发现PANX1在人卵中的表达显著高于鼠卵,推测这可能是突变鼠无表型的原因。进一步制作了在卵子特异表达的野生型及突变型PANX1过表达鼠模型。点突变鼠模型表现为不孕,且准确模拟出了卵子死亡的表型(图2)。此研究发现了人类新的孟德尔遗传病、糖基化疾病及离子通道疾病-卵子死亡;揭示了PANX1突变致疾病产生并明确了致病机制;同时也提供了首个深入研究PANX1病理学功能的鼠模型。
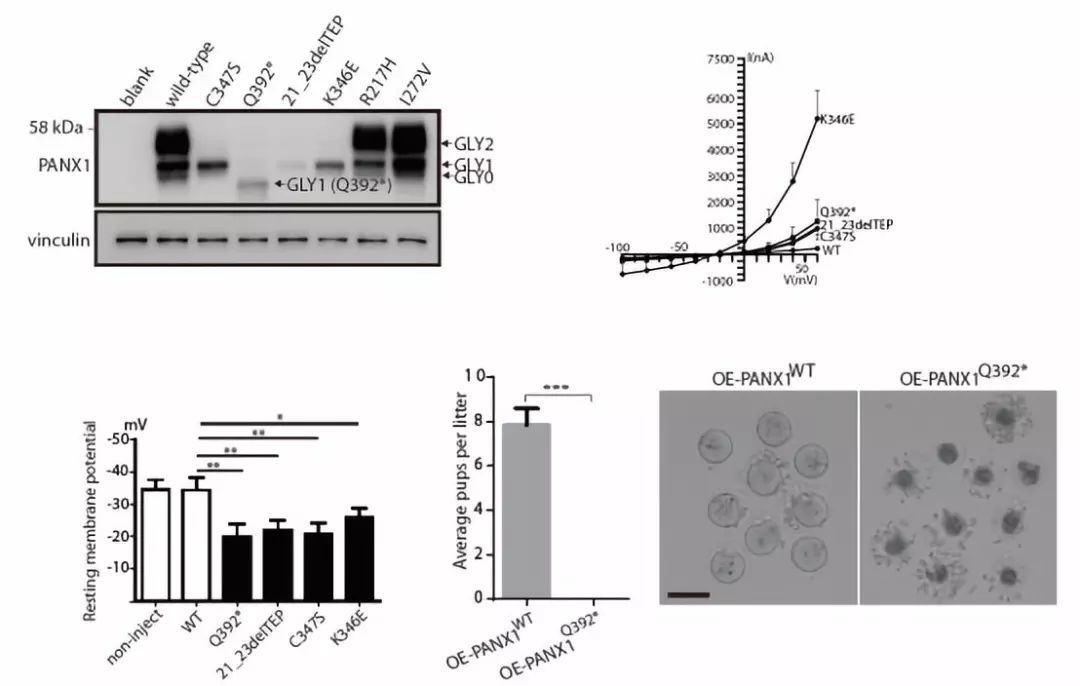
(图2)
据悉,桑庆副研究员、王磊教授、匡延平教授为本论文的通讯作者。复旦大学生物医学研究院博士研究生张治华、西北妇女儿童医院师娟子教授,复旦大学附属红房子医院孙晓溪教授、九院生殖中心李斌、闫铮为共同第一作者。中科院神经所竺淑佳团队,孙强研究员亦参与了此项研究。
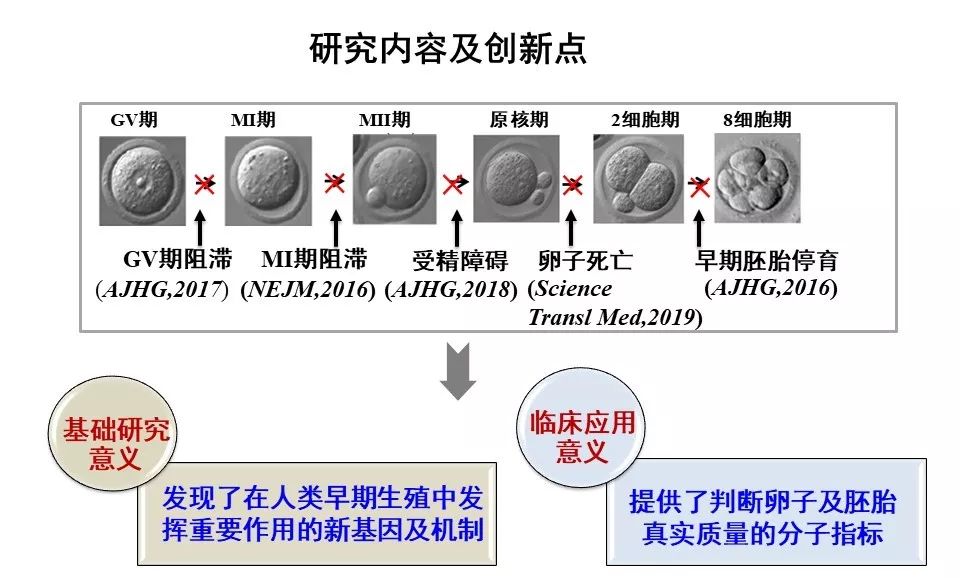
复旦大学王磊、桑庆团队联合其他研究者近几年关注于人类早期生殖异常的遗传学研究,相继在N Engl J Med (2016), Science Transl Med (2019), Am J Hum Genet(2016, 2017, 2018)等发表了论文。陆续发现了此过程中的2种新孟德尔遗传病、5个新致病基因并阐明了部分基因的机制(下图)。扩展了对人类孟德尔疾病的认知;揭示了人类卵子及早期胚胎发育中隐藏着大量前所未知的新基因;同时,也为相关患者的遗传咨询及实现辅助生殖中的精准医学实践奠定了基础。
原文链接:
http://stm.sciencemag.org/content/11/485/eaav8731/tab-pdf
制版人:半夏
参考文献
1、Bergoffen, J., Scherer, S. S., Wang, S., Scott, M. O., Bone, L. J., Paul, D. L., ... & Fischbeck, K. H. (1993). Connexin mutations in X-linked Charcot-Marie-Tooth disease. Science, 262(5142), 2039-2042.
2、Kelsell, D. P., Dunlop, J., Stevens, H. P., Lench, N. J., Liang, J. N., Parry, G., ... & Leigh, I. M. (1997). Connexin 26mutations in hereditary non-syndromic sensorineural deafness. Nature, 387(6628), 80.
3、Denoyelle, F., Lina-Granade, G., Plauchu, H., Bruzzone, R., Chaïb, H., Lévi-Acobas, F., ... & Petit, C. (1998). Connexin 26 gene linked to a dominant deafness. Nature, 393(6683), 319.
4、Richard, G., Smith, L. E., Bailey, R. A., Itin, P., Hohl, D., Epstein Jr, E. H., ... & Bale, S. J. (1998). Mutations in the human connexin gene GJB3 cause erythrokeratodermia variabilis. Nature genetics, 20(4), 366.
5、Xia, J. H., Liu, C. Y., Tang, B. S., Pan, Q., Huang, L., Dai, H. P., ... & Shi, X. L. (1998). Mutations in the gene encoding gap junction protein β-3 associated with autosomal dominant hearing impairment. Nature genetics, 20(4), 370.
6、Grifa, A., Wagner, C. A., D'Ambrosio, L., Melchionda, S., Bernardi, F., Lopez-Bigas, N., ... & Zelante, L. (1999). Mutations in GJB6 cause nonsyndromic autosomal dominant deafness at DFNA3 locus. Nature genetics, 23(1), 16.
7、Mackay, D., Ionides, A., Kibar, Z., Rouleau, G., Berry, V., Moore, A., ... & Bhattacharya, S. (1999). Connexin46 mutations in autosomal dominant congenital cataract. The American Journal of Human Genetics, 64(5), 1357-1364
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652468104&idx=2&sn=e13d5a21df7deb365c70ceb8c1a3ed8d&chksm=84e2e03cb395692ad38278165ea1aeb2ee023771755bfd8fe18a209980ac88e983c320b802f0&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

健康预报|“神兽”返校健康提醒
口腔健康,全身健康,这些健康贴士你get了吗?

【健康】厨房油烟,健康的“隐形杀手”

健康科普 | 懂健康知识,做健康老人

口腔健康 全身健康
“健康扶贫”引领健康生活




【健康】自己带便当,怎样更健康?
石远凯的面对面视频

健康‖耳鼻喉健康无“小”事

【健康】这样做饭更健康!专家教你如何健康烹调