科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-03-31
来源:BioArt
撰文:敏君
肠道微生物群落和肠上皮特异性病原菌的生长依赖于快速消耗宿主体内的营养物质。病原菌进入宿主肠道后必然会与内源性微生物群落争夺营养和能量等资源,病原菌生长因而易受抑制【1】。由于代谢上的需求类似,资源的争夺在诸如共生性大肠杆菌与近缘致病性大肠杆菌这类同一物种的不同变种间尤为激烈。在长期进化过程中,病原菌产生了多种防御策略以抵御内生菌获取宿主营养【2】,然而病原菌克服宿主营养限制的分子机制仍不清楚。
2019年3月28日,来自以色列耶路撒冷希伯来大学的Ilan Rosenshine和Sigal Ben-Yehuda教授带领的团队在Cell 杂志联合发表题为Pathogenic E. coli extracts nutrients from infected host cells utilizing injectisome components文章,揭示了致病性大肠杆菌可以通过注射体(Injectisome)注射宿主细胞以摄取养分,从而在与内源性微生物的竞争中维持生长。

肠致病性大肠杆菌(Enteropathogenic E. coli, EPEC)是一种在人类中特有的病原体,含有一个称为肠细胞脱落位点(locus of enterocyte effacement,LEE)的毒力岛(pathogenicity island),LEE是病原菌毒力的中心,它含有约40个基因,其中包括一种编码分子注射器称为注射体(injectisome)的基因。注射体由III型分泌系统(type III secretion system, T3SS)和相关蛋白共同组成,能够将数十种效应蛋白从细菌细胞质注入宿主细胞【3】。
注射体和鞭毛是在进化上类似的分子机器,它们都含有完整的T3SS结构,其中最保守的五种组分统一称为SctRSTUV蛋白。SctRSTUV蛋白形成一种膜嵌入式复合物的“输出装置”,称为CORE(图1)。CORE组件插入细胞膜,SctRSTUV五种蛋白按一定比例组装成复合体,对注射体或鞭毛生物功能至关重要。在这些过程中,CORE控制底物接近T3SS中心管,并参与底物识别【4】,还能利用质子动力来驱动分泌系统【5】。先前的研究主要阐释了CORE作为注射体组分编码蛋白的功能,而该研究首次报道了CORE蛋白能够作为病原菌从宿主细胞摄取营养的通道。
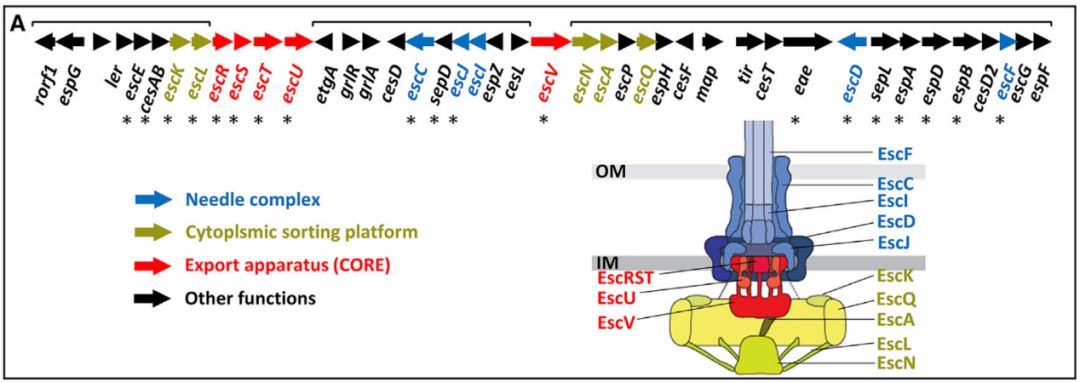
图1 CORE组件结构
在该研究中,研究者构建了肠致病性大肠杆菌(EPEC)营养缺陷型突变体△proC,发现宿主吸附型EPEC具有从宿主细胞获得氨基酸并合成蛋白的能力,作者称之为宿主营养摄取(host nutrient extraction,HNE)。钙黄绿素荧光示踪分析表明HNE是由宿主细胞质分子流入EPEC介导的,并且EPEC中具有LEE结构域是进行HNE的充要条件。此外,编码注射体组分的CORE蛋白对于HNE是必需的,其表达能刺激膜纳米管的形成,CORE依赖性膜纳米管能桥连细菌和受感染的宿主细胞,诱导HNE的发生。
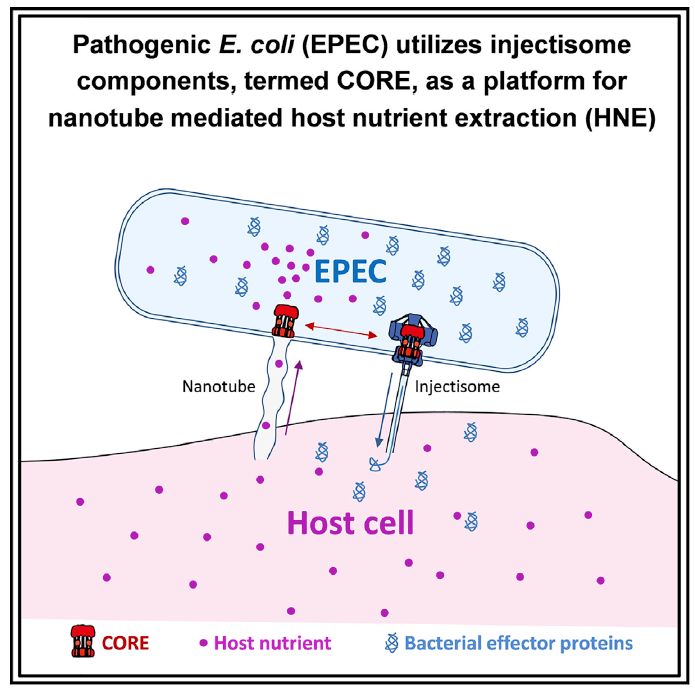
进一步研究表明,大多数的细菌能够同时执行HNE和效应物注射两种功能。不同注射体和鞭毛的COREs蛋白均能促进纳米管形成以及HNE发生,表明CORE蛋白在生有鞭毛或具有注射体的革兰氏阴性菌或革兰氏阳性菌中的双重功能。
综上所述,宿主营养摄取是病原体内广泛存在的毒力策略,能协助病原体在与内生菌的激烈竞争中生存,而注射体组件CORE蛋白是EPEC摄取宿主营养的充要条件。
原文链接:
https://doi.org/10.1016/j.cell.2019.02.022
制版人:珂
参考文献
1. Chung, L.K., and Raffatellu, M. G.I. pros: Antimicrobial defense in the gastrointestinal tract. Semin. Cell Dev. Biol (2018).
2. Perez-Lopez, A., Behnsen, J., Nuccio, S.P., and Raffatellu, M. Mucosal immunity to pathogenic intestinal bacteria. Nat. Rev. Immunol 16, 135–148 (2016).
3. Deng, W., et al. Assembly, structure, function and regulation of type III secretion systems. Nat. Rev. Microbiol 15, 323–337 (2017)
4. Dietsche, T., et al. Structural and functional characterization of the bacterial type III secretion export apparatus. PLoS Pathog 12, e1006071 (2016).
5. Lee, P.C., and Rietsch, A. Fueling type III secretion. Trends Microbiol 23, 296–300 (2015).
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652468198&idx=1&sn=095ac0ee0e82bd1e68778597452ae0cb&chksm=84e2e052b39569440211ef68919d519fd7bde2d35c7d6549f5e03ed20de439e5a3807e9a0d4c&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
空气微生物检测
微生物复垦

“消失”的微生物
微生物接种剂:银色子弹还是微生物侏罗纪公园?
叶面微生物

我国最大乳酸菌种资源库建成
微生物失踪
口腔微生物会破坏阴道微生物平衡

微生物组科技
根际微生物