科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-08-28
来源:CBG资讯
导语
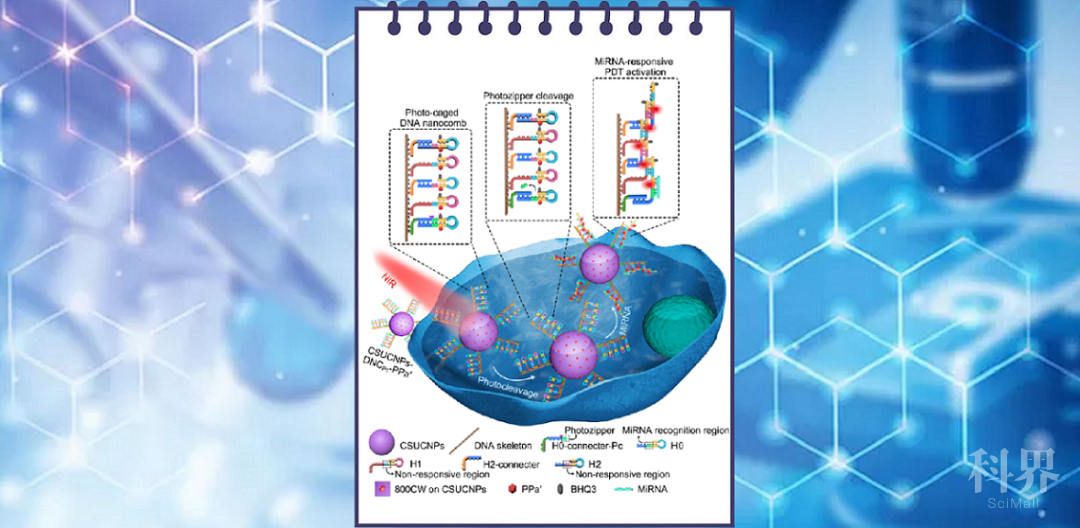
光动力治疗(PDT)是一种通过光敏剂产生活性氧来诱导癌细胞凋亡的癌症治疗方法,可对多种癌症进行非侵入性治疗。由于肿瘤早期表现出特定microRNA(miRNA)的异常高表达,miRNA响应激活的光敏剂在光动力治疗中引起关注。然而,体循环中的RNA会在负载光敏剂的纳米探针到达肿瘤细胞前引起非特异性激活,导致对正常组织器官的毒副作用。因此,开发外部开关来调控miRNA响应的光敏剂激活,是实现精准PDT的关键。近日,南京大学生命分析化学国家重点实验室鞠熀先教授研究团队在该领域取得了新进展,提出了早期癌症的精准治疗方法(Angew. Chem. Int. Ed., DOI: 10.1002/anie.202009263)。
鞠熀先教授简介

鞠熀先教授,1986、1989、1992年分别获南京大学理学学士、硕士与博士学位后留校任教,1993年聘为副教授。1996-1997年为加拿大Montreal大学博士后,1999年任南京大学教授、博士生导师、分析学科主任。2003年获国家杰出青年科学基金,2007年成为教育部“长江学者”和“新世纪百千万人才工程”国家级人选,2009年聘为“973”计划项目首席科学家,2005-2014年为国家自然科学基金创新研究群体项目的负责人;2011年获国务院政府特殊津贴,并出任新建“生命分析化学国家重点实验室”主任至今,2015年被选为国际电化学会会士、英国皇家化学会会士。
研究方向为分子诊断与生物分析化学,主要研究领域为免疫分析、细胞分析化学、纳米生物传感和临床分子诊断。发表论文712篇(SCI刊物657篇,>5刊物434篇);授权专利26件,Elsevier、Springer和RSC出版专著4部、中文专著、教材7部,专章20篇;至2020.8.20论文被SCI刊物引用32500 (他引31258次),h-index为93(Google Scholar h-index为102,引用37686次)。
兼任中国仪器仪表学会分析仪器分会副理事长、电分析化学专家组主任、化学传感器专家组副主任;中国化学会分析化学学科委员会副主任、有机分析专业委员会副主任、化学生物学专业委员会委员、糖化学专业委员会委员;中国生物工程学会生物传感-生物芯片-纳米生物技术专业委员会副主任,中国药理学会分析药理学专业委员会副主任,中国产学研合作促进会生物检测监测产业技术创新战略联盟副理事长;江苏省化学化工学会常务理事、分析化学专业委员会主任、质谱专业委员会副主任;江苏省分析测试协会副理事长。《Front. Chem.: Anal. Chem.》主编,《Sensors》、《J. Anal. Testing》、《Telomere & Telomerase》副主编,《Electroanalysis》、《Anal. Lett.》、《中国科学:化学》(2008-2017)、《Chin. J. Chem.》、《分析化学》、《Chemosensors》《Open Biomarkers J.》等刊编委。
获中国化学会青年化学奖、梁树权分析化学基础研究奖,江苏省青年科学家奖称号;2019年获中国化学传感器首届雷磁杰出成就奖,2001、2009、2013年获教育部自然科学一等奖3项,2011、2014、2016年江苏省科学技术一等奖3项(2项合作),2008、2009、2019年江苏省科学技术二等奖3项,2015、2018年江苏省科学技术三等奖2项(合作),2017年重庆市科学技术一等奖(合作),2008、2009、2014年获中国分析测试协会科学技术一等奖3项,曾获教育部科技进步三等奖(第二完成人)2项。
前沿科研成果
早期癌症的精准治疗方法
上转换纳米粒子(UCNPs)可以在近红外光下发射紫外/可见光。鞠熀先教授研究团队近年来利用UCNPs的这一性质,提出了用于癌症基因治疗的上转换纳米胶囊(Biomaterials 2018, 163, 55)与上转换纳米“洋葱”(Biomaterials 2019, 225, 119501)、化疗的偶氮苯-DNA纳米泵(Angew. Chem. Int. Ed. 2019, 58, 18207)和PDT的“能量集中域”策略(Angew. Chem. Int. Ed. 2019,58, 12117),提升了UCNPs的能量转移效率与发光强度,改善了癌症基因治疗、化疗和PDT的治疗效率。
近期,该研究组针对体循环中RNA干扰miRNA响应激活光敏剂的问题,利用其设计的光响应性DNA纳米梳,研制了一种近红外光调控的miRNA放大器,并结合UCNPs的近红外光激发、多短波长发射的性质实现了早期癌症的精准光动力治疗。DNA纳米梳由“光拉链”保护的发夹H0和特定的发夹H1与H2交替组装在长链DNA骨架上构成,它通过共价连接修饰在核壳UCNPs(NaYF4:Tm,Yb,Gd@NaYF4:Nd,Yb)表面(图1)。三种发卡均标记有光敏剂PPa'(焦脱镁叶绿酸-a的衍生物)以及对应的猝灭剂(BHQ)。在808 nm激光照射下,UCNPs发射出紫外光,切断“光拉链”使其脱落,从而暴露出miRNA-21识别区域。该区域在癌细胞过表达的miRNA-21作用下发生级联杂交反应,放大激活发卡中修饰的光敏剂PPa',在UCNPs同时发射的蓝光激发下产生活性氧,以实现早期癌症的高效精准PDT。体外实验证明,“光拉链”可成功封闭miRNA-21的识别区域,在近红外光下,miRNA-21可以有效触发级联杂交反应及其放大效应。细胞与活体实验证明,该miRNA放大器可以有效抑制癌细胞的增殖以及小鼠体内早期肿瘤的生长。因此,该策略在早期癌症的精准治疗中具有很好的应用前景。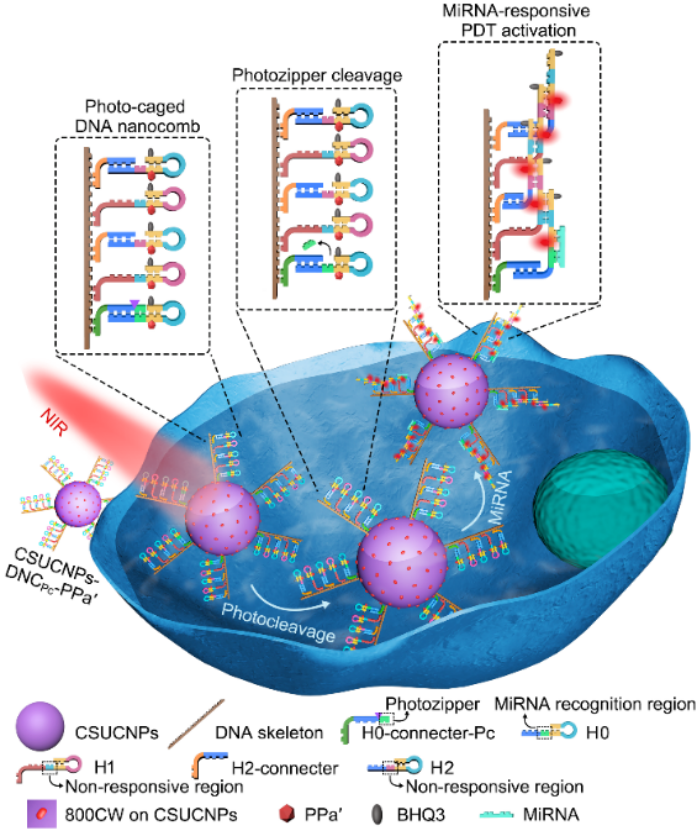
(来源:Angew. Chem. Int. Ed.)
上述相关成果已以“Near-Infrared Photo-Switched MicroRNA Amplifier for Precise Photodynamic Therapy of Early-Stage Cancers”为题发表于Angew. Chem. Int. Ed.(DOI: 10.1002/anie.202009263)。博士生张玥和研究助理陈伟伟为该工作的共同第一作者,鞠熀先教授和刘颖教授为共同通讯作者。
来源:BeanGoNews CBG资讯
原文链接:https://mp.weixin.qq.com/s?__biz=MzI4ODQ0NjUwMg==&mid=2247507744&idx=2&sn=bae143ee3fa61d83684327f8e0211137&chksm=ec3cde69db4b577ff850e1748101ce4810ded5a88b99637005f56eb8e001f261fa3255b894e6#rd
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
免疫治疗研究 开启癌症治疗新方向

Nature:如何调整饮食,强化癌症治疗?

癌症治疗革命性研究方法
免疫治疗研究 开启癌症治疗新方向

生物技术
用于癌症治疗的智能纳米药物
微生物的癌症治疗潜力:肠噬菌体改善癌症的治疗功效
以毒攻毒?癌症治疗新方法
抗生素能治疗癌症吗?
中国抗癌协会王瑛秘书长出席河北省肿瘤防治宣传周启动仪式


