科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-05-08
来源:BioArt
撰文 | Lily
众所周知,癌症发生原因一方面由于原癌基因(oncogene)的激活,另一方面由于抑癌基因 (tumor suppressor) 的失活。如果把癌症的生长比喻成一辆行驶的汽车的话,那么原癌基因的激活就是猛踩油门,而肿瘤抑制基因的失活就是刹车系统失灵 【1】。
为了研究人类癌症,研究者们开发了基因改造的小鼠模型(GEMM),利用Cre-Loxp系统特异性地敲除或突变特定基因从而诱发癌症。比如肠癌的GEMM拥有Villin启动因子驱动的Cre使得癌症只发生在肠子里【2】;前列腺癌的GEMM拥有由PB驱动的Cre使得癌症只发生在前列腺里【3】;胰腺癌的GEMM拥有由Pdx-1驱动的Cre使得癌症便只发生在胰腺里【4】;通过运用不同的启动因子来驱动Cre,研究者们可以让致癌突变发生在指定部位,从而研究不同器官或组织的癌变和肿瘤的发展。
然而在现实中,人体里哪个部位会长肿瘤可不是像GEMM那样简单由Cre说了算的。事实上,不同的组织对于同样的基因突变有着截然不同的反应。癌症会出现在哪?为什么一些先天基因突变会在特定的组织引发癌症而不在其它组织中诱发?这种组织倾向性的机制是什么?这些问题的答案一直模糊不清。
近日,来自基因泰克公司 (Genentech) 生理化学部门的Vishva M. Dixit与病理部门的Kim Newton联合在Science杂志上发表了题为Intrinsic apoptosis shapes the tumor spectrum linked to inactivation of the deubiquitinase BAP1 的长文,报道了关于癌症的组织倾向性的重大进展——去泛素化酶BAP1的缺失或失活会在小鼠胚胎干细胞 (ES cells) 、成纤维细胞 (fibroblasts) 、肝组织和胰腺组织中引发由泛素连接酶RNF2介导的细胞凋亡通路,而BAP1的缺失却不能在黑素细胞和间皮细胞中引发同样的细胞凋亡通路。相反,BAP1的缺失会在黑素细胞中促进黑色素瘤致癌基因Mitf的表达并促进肿瘤的发生【5】。

在人体中,去泛素化酶BAP1的先天杂合子突变往往会提高葡萄膜黑色素瘤(葡萄膜为眼球壁的中间层)、间皮瘤和肾细胞癌的发病率。作为一个经典的“双击型”(double-hit)肿瘤抑制基因(即双等位基因全都失活或缺失),BAP1的缺失还常伴随着其它致癌基因的突变来共同促进肿瘤的发生,比如在黑色素瘤中,BAP1突变总是伴随着BRAF突变;在葡萄膜黑色素瘤中,BAP1突变总是伴随着GNAQ和GNA11突变;在间皮瘤中,BAP1突变总伴随着CDKN2A和NF2突变。而这些突变的组合在小鼠中也会引发相应的癌症。总而言之,去泛素化酶BAP1在人体和小鼠中都起到抑制肿瘤发生的作用。
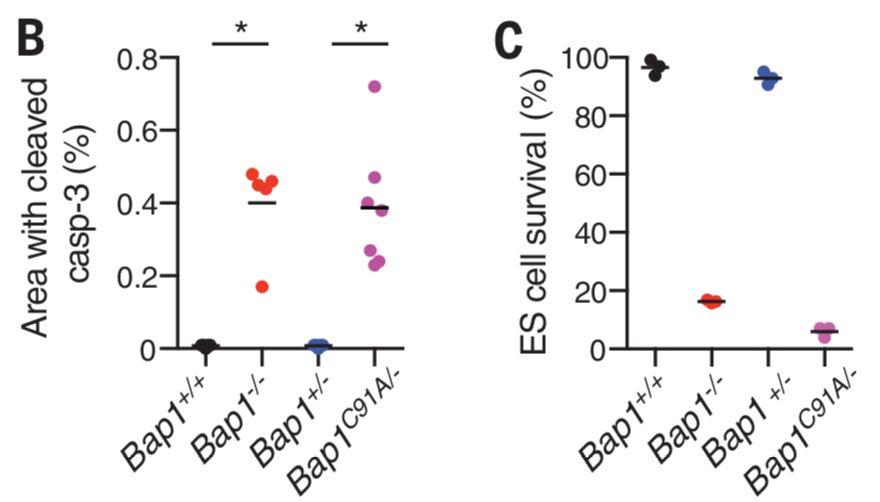
为了研究BAP1是如何抑制肿瘤发生的,研究者们制作了Bap1-/-和BapC19A/-两种可诱导型小鼠。在他莫昔芬(tamoxifen)的诱导下,前者会在体内失去Bap1蛋白,而后者则会失去Bap1蛋白的酶活性。在诱导BAP1缺失或失活后四周内,成年小鼠出现脾肿大、白细胞增多、中性粒细胞增多、贫血、血小板减少、肝损伤和胰腺萎缩等。这些表型证明了BAP1的酶活性对于造血以及肝脏和胰腺的正常运转是非常重要的。同时,和携带Bap1活性的小鼠相比,Bap1缺失或失活的小鼠在肝和胰腺组织中表达了更多的活性caspase-3蛋白,意味着更多的细胞凋亡 (下图B);而这些小鼠的胚胎干细胞 (ES cells) 、角质细胞和E1A永生小鼠胚胎成纤维细胞(E1A-immortalized MEFs)的存活率也大大降低 (下图C为ES细胞的存活率)。为了研究这些细胞的低存活率是否由细胞凋亡引起,研究者们分析了这些细胞的caspase-3及其底物PARP的活性,发现两者皆处于活化状态;而caspase抑制剂的加入则可以避免细胞凋亡。这些数据证明了Bap1缺失或失活所导致的低存活率是由细胞凋亡所引起。
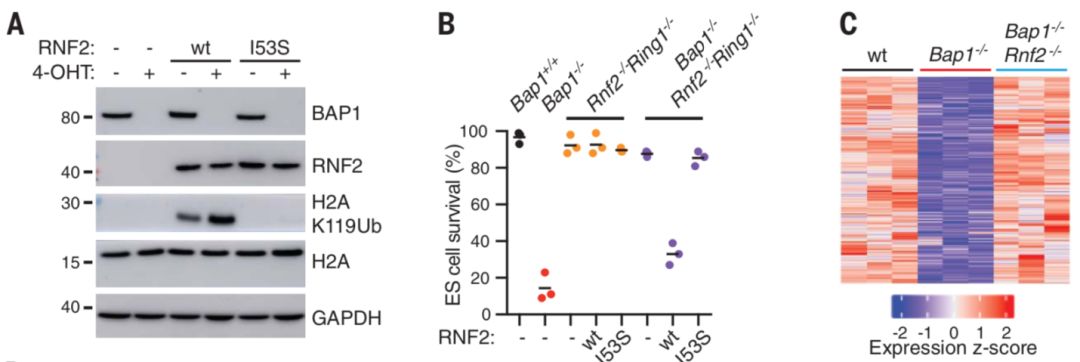
为了研究Bap1的缺失或失活导致细胞凋亡的机制,研究者们做了一个全基因组CRISPR-Cas9筛选,发现Bap1缺失或失活引起的细胞凋亡主要是由Rnf2调控的。Rnf2是一种E3泛素链接酶,主要负责在组蛋白H2A的119号赖氨酸处添加一个泛素。有意思的是,Bap1刚好可以去除Rnf2添加的这个泛素。于是研究者们猜想,Bap1缺失之后,Rnf2通过介导H2AK119的泛素化促进了细胞凋亡。
为验证这一猜想,研究者们首先在Bap1缺失的ES细胞中敲除了Rnf2和一个跟Rnf2有同样功能的E3连接酶Ring1,然后观察细胞的存活率。数据结果显示,敲除Rnf2或者双敲除Rnf2和Ring1都可以挽救Bap1-/- ES细胞的存活率,这证明了Rnf2和Ring1都参与了Bap1缺失引起的细胞凋亡过程(单独敲除Ring1,收益并不明显)。为了验证Rnf2的酶活性是否参与了细胞凋亡,研究者们在Bap1fl/flRnf2-/-Ring1-/-ES细胞重新表达了WT(即有酶活性的)Rnf2和失活的Rnf2,然后观察H2AK119泛素化和ES细胞的生存率。数据表明WT Rnf2的表达直接决定着H2AK119泛素化:在WT Rnf2表达的情况下,Bap1缺失会引起 H2AK119泛素变高,细胞存活率变低;而在Rnf2失活的情况下,H2AK119不再出现泛素,Bap1缺失也不会导致细胞存活率变低(下图AB)。为了研究Rnf2是如何调控Bap1-/- ES细胞的基因表达的,研究者们比较了WT、Bap1-/-和Bap1-/-Rnf2-/-ES细胞的RNA-seq数据,发现了Bap1缺失导致的很多基因变化都受Rnf2调节(下图C)。
这些受Rnf2调节的基因中包括抗细胞凋亡基因Bcl2和Mcl1,它们的表达量在Bap1缺失或失活的ES细胞中非常低,但是在WT或者Bap1-/-Rnf2-/- ES细胞中却很正常。为了研究者Bcl2和Mcl1对于Bap1缺失引起的细胞凋亡是否重要,研究者们将两个基因过表达在Bap1-/- ES细胞中,发现ES细胞的存活率被挽救了。那么Bap1和Rnf2是否能直接调控Bcl2呢?为了搞清这个问题,研究者们做了ChIP-seq,发现Bap1和Rnf2可以直接和Bcl2的启动子结合。有趣的是,Bap1和Rnf2对于和Bcl2启动子的结合是竞争关系。在Bap1缺失的情况下,Rnf2跟Bcl2启动子和H2A的结合力度更高了,同时Bcl2启动子区域的H2AK119泛素也增高了。和这个数据相符的是,Bcl2和Mcl1的蛋白量在Bap1-/- ES细胞中也变低了。
研究者们还查看了除Bcl2以外的其它Bcl2家族蛋白,但这些蛋白在Bap1-/- ES细胞中并没有变化。然而当研究者们在Bap1-/- ES细胞中敲除了Bcl2家族中的促进细胞凋亡基因Bak和Bax时,细胞内活性Caspase-3表达降低,而细胞凋亡减少,这意味着Bap1的缺失激活了内源性细胞凋亡通路。
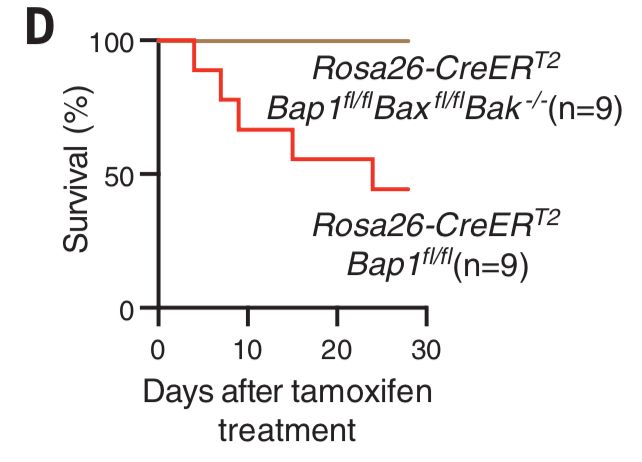
那么细胞凋亡通路的激活是否也是造成Bap1-/-小鼠死亡的主要原因呢?为了研究这个问题,研究者们制作了Bap1fl/flBaxfl/flBak-/-诱导型小鼠,发现了在tamoxifen诱导敲除的四周内,Bap缺失的小鼠存活率较低,但额外移除了Bax和Bak的小鼠可以百分百存活(下图)。进一步的研究发现,在这些缺失Bap1、Bax和Bak的小鼠体内,肝和胰腺的活性caspase-3变少了,肝损伤和胰腺萎缩变少了,先前描述的贫血等症状也消失了,血清中的CXCL5增高了,而G-CSF、IFNγ、CCL12等细胞因子则减少了。这些数据证明了Bap缺失导致的小鼠造血失常、肝和胰腺的损伤和高死亡率主要是由促进细胞凋亡因子Bax/Bak引导的细胞凋亡所造成的。
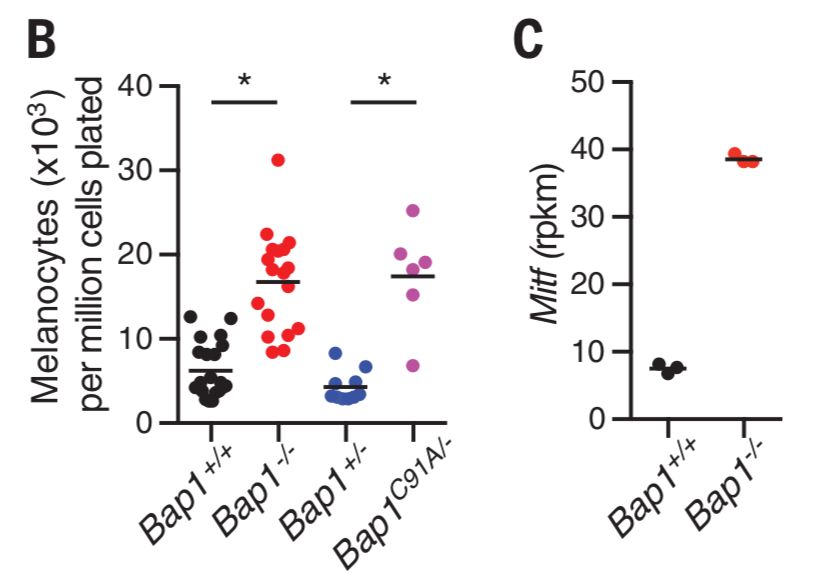
下一个问题是,Bap1的缺失是否也会在那些容易长肿瘤的组织里引发细胞凋亡呢?为了研究这个问题,研究者们从Bap1fl/fl小鼠的新生儿身上取了一些表皮,制成细胞溶液后加入了tamoxifen来诱导Bap1的敲除,四天之后他们拿着这些细胞去做了single-cell RNA-seq,并用黑色素瘤致癌基因Mitf以及相关基因来标注黑素细胞。令人惊讶的是,Bap1+/+细胞溶液中的黑素细胞仅占1%,而Bap1-/-细胞溶液中的黑素细胞则占3%。四周之后,Bap1-/-细胞溶液中的黑素细胞比对照组的黑素细胞长得更多了(下图B),而且黑色素瘤致癌基因Mitf的表达也远远高于对照组(下图C)。显然,Bap1缺失或失活并没有引起黑素细胞的凋亡,反而还促进了它的分化或者增殖。同样的结果也出现在了间皮细胞中。
研究者们还检查了这两种细胞的Bcl2和Mcl1的表达量,发现Bap1的缺失没有对它们造成任何影响;研究者们又检查了Rnf2对Bcl2启动子结合的情况,发现Bap1的缺失也没有引发更高的Rnf2与Bcl2启动子的结合。研究者们又拿RNA-seq数据比较了ES细胞和黑素细胞及间皮细胞的由Bap1缺失造成的基因表达变化,发现同样是Bap1缺失,但是基因表达变化在ES细胞和在黑素细胞及间皮细胞却有很大不同。这些数据正说明了细胞型决定了Bap1的作用和角色。
总而言之,这些数据证明了虽然很多细胞在Bap1的缺失下由于细胞凋亡通路的激活导致无法存活,但是在一些容易癌化的细胞里,比如黑素细胞里,Bap1的缺失并不会引发细胞凋亡,相反,Bap1的缺失还会促进肿瘤的产生。类似的基因还有BRCA1, RB和WT1,他们都具有组织倾向性,而我们并不知道他们是如何控制不同组织的细胞凋亡,未来还需要进一步的研究。
参考文献
1. Weinberg, Robert Allan, and Robert A. Weinberg. The biology of cancer. Vol. 1. New York: Garland science, 2007.
2. Marjou FE, Janssen K-P, Chang BH-J, Li M, Hindie V, Chan L, et al. Tissue-specific and inducible Cre-mediated recombination in the gut epithelium. genesis. 2004;39(3):186–93.
3. Wu X, Wu J, Huang J, Powell WC, Zhang J, Matusik RJ, et al. Generation of a prostate epithelial cell-specific Cre transgenic mouse model for tissue-specific gene ablation. Mech Dev. 2001 Mar 1;101(1):61–9.
4. Lee JW, Komar CA, Bengsch F, Graham K, Beatty GL. Genetically Engineered Mouse Models of Pancreatic Cancer: The KPC Model (LSL-KrasG12D/+;LSL-Trp53R172H/+;Pdx-1-Cre), Its Variants and Their Application in Immuno-oncology Drug Discovery. Curr Protoc Pharmacol Editor Board SJ Enna Ed--Chief Al. 2016 Jun 1;73:14.39.1-14.39.20.
5. He M, Chaurushiya MS, Webster JD, Kummerfeld S, Reja R, Chaudhuri S, et al. Intrinsic apoptosis shapes the tumor spectrum linked to inactivation of the deubiquitinase BAP1. Science. 2019 Apr 19;364(6437):283–5.
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652469592&idx=2&sn=6ecb740e25000156fd8121e6b5284215&chksm=84e2eaecb39563fa61111d967d12dc3472237f7a643f2d8f13da50137c446a5d567b364669db&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
研究揭示泛素连接酶TRIM27促进肠道干细胞自我更新维持肠道稳态新机制

香港科大唐本忠院士:原位监测细胞凋亡过程的自报告光敏剂

饶枫/汪涛组揭示代谢小分子调控CRL泛素连接酶拟素化修饰的功能与机制
水生所揭示ELL作为E3泛素连接酶的新功能
科学家创制首个植物E3泛素连接酶文库

泛素连接酶COP1作为神经炎症“刹车”的机制
Cell Res | 广州医科大学唐道林团队揭示调节细胞死亡分子机制

PNAS :茉莉酸信号途径调控新机制,E3泛素连接酶调节MYC蛋白稳定性
版纳植物园揭示泛素连接酶PUB8调控幼苗早期生长的新机理

香港科技大学唐本忠院士:原位监测细胞凋亡过程的自报告光敏剂