科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-09-07
来源:BioArt
分子生物学的中心法则(Central dogma)包括了三个主要的过程:复制(replication)、转录(transcription)和翻译(translation),描述了遗传信息由DNA到RNA到蛋白质的传递过程。其中,转录过程由RNA聚合酶以DNA为模板,转录生成信使RNA (mRNA);翻译过程由核糖体以信使RNA为模板,利用氨基酸合成蛋白质。在细菌中,转录和翻译过程在相同时间相同位置内进行。早在1970年,O. L. Miller等人就通过电镜观察到大肠杆菌体内多个核糖体结合在同一条信使RNA上,并在此信使RNA起始位点发现可能的转录中RNA聚合酶【1】。之后的研究进一步发现,RNA聚合酶的转录速度受到mRNA上结合的第一个核糖体(“lead ribosome”)调节【2】,同时一系列重要的转录因子也被发现,参与了转录翻译协同过程(transcription-translation coupling)的调控。其中最重要的包括NusG/RfaH 转录调控因子家族蛋白【3】。
NusG/RfaH 转录调控因子蛋白包含N端,C端两个保守结构域,其中N端结构域与RNA聚合酶的β,β’亚基结合,C端结构域与核糖体蛋白S10结合。两个保守结构域之间由一段相对自由活动的氨基酸loop连接。因此,NusG/RfaH 转录调控因子被认为在可能存在的细菌转录翻译协同过程中起到了重要的桥梁连接作用【3】。
2017年,Science 报道了Cramer及其合作者解析的7.6 Å转录翻译复合体结构,命名为expressome。作者以一个停止状态的RNA聚合酶延伸复合体,通过其信使RNA,结合核糖体并使其进行翻译,直至最终与RNA聚合酶碰撞结合的方式获得样品,并通过冷冻电镜的方法解析出其蛋白质复合体三维结构。结构显示了在此状态下的转录翻译复合体中RNA聚合酶和核糖体各亚基之间相互作用的可能氨基酸位点,证明了在分子层面转录翻译协同过程的存在。

然而就像文章的通讯作者之一R. Landick教授接受美国生物化学与分子生物学学会采访时所说:“像所有好的研究结果一样,这篇文章没能回答所有的问题,而是因此提出了更多的问题 (“like all good results do, more questions than there are answers”)”: 在其解析的转录翻译复合体结构中,并没有NusG/RfaH转录调控因子;RNA聚合酶NusG/RfaH转录调控因子C端结构域结合位点,与核糖体S10的距离大约为160 Å,远远超过NusG/RfaH转录调控因子N端,C端之间氨基酸loop所能延申长度的极限。因此NusG/RfaH 转录调控因子是否参与了细菌转录翻译协同过程的调控;其参与调控的分子机理是什么;Cramer等人所解析的“expressome“转录翻译复合体结构是否是细菌转录翻译协同过程中真实存在的状态;在协同过程中是否存在其他状态的转录翻译复合体结构等,都是在此研究结果之后亟需回答的问题。
2020年8月20日,美国罗格斯大学(Rutgers University)Richard Ebright研究团队在Science上发表了题为Structural basis of transcription-translation coupling 的研究论文。该论文揭示了在大肠杆菌中NusG转录因子参与转录翻译协同过程的作用机理;并进一步发现另一转录因子NusA在协同过程中的重要作用;最终解析了依赖于NusG, NusA转录因子的转录翻译协同过程的分子机理。

与Cramer等人构建expressome复合体的方法不同,Richard Ebright研究团队首先构建了一系列RNA聚合酶延申复合体:包括RNA聚合酶,NusG转录因子,10碱基长度DNA转录泡(transcription bubble)以及7种不同长度的信使RNA(包括5’端AUG碱基;4,5,6,7,8,9和10密码子各长度碱基;9nt转录泡配对碱基);利用tRNA固定信使RNA,使其结合于核糖体P-site位置;最终将获得的样品利用冷冻电镜方法解析其三维结构。这种含有不同长度信使RNA的复合体,能很好的模拟核糖体不断接近转录中RNA聚合酶时可能存在的转录翻译协同过程。
通过解析这一系列复合体结构,作者发现当信使RNA spacer长度为4,5,6,7和8密码子长度时,复合体呈现“expressome”一致的三维构象,作者将此构象命名为转录翻译协同复合体A(trancription-translation coupling complex A, TTC-A)。在此构象中,信使RNA从RNA聚合酶RNA释放通道口(RNA exit channel)直接进入核糖体信使RNA进入通道(ribosome mRNA-entrance portal);NusG位于远离核糖体S10的一侧,且只有N端结构域结合于RNA聚合酶上;在不加入NusG转录因子时,此状态构象仍可存在;在RNA聚合酶中缺少w亚基电子云;结构模拟显示,此构象结构不能进一步结合其他转录调控因子。这些结构预示TTC-A可能是一种特殊状态的转录翻译协同复合体构象;或是由于RNA聚合酶和核糖体距离过近造成的碰撞所导致的构象(“collision-ome” or “crash-ome”)。
有趣的是,当信使RNA spacer长度为8,9或10密码子长度时,复合体呈现另一种三维构象,作者将此构象命名为转录翻译协同复合体B(transcription-translation coupling complex B, TTC-B)。在此构象中,信使RNA从核糖体S3亚基表面延申进入核糖体;具有完整的NusG电子云,并且由N端结构域与RNA聚合酶结合,C端结构域与核糖体S10亚基结合;当不加入NusG时,复合体无法形成。因此作者认为,TTC-B是依赖NusG的转录翻译协同复合体构象(NusG-dependent transcription-translation coupling)。
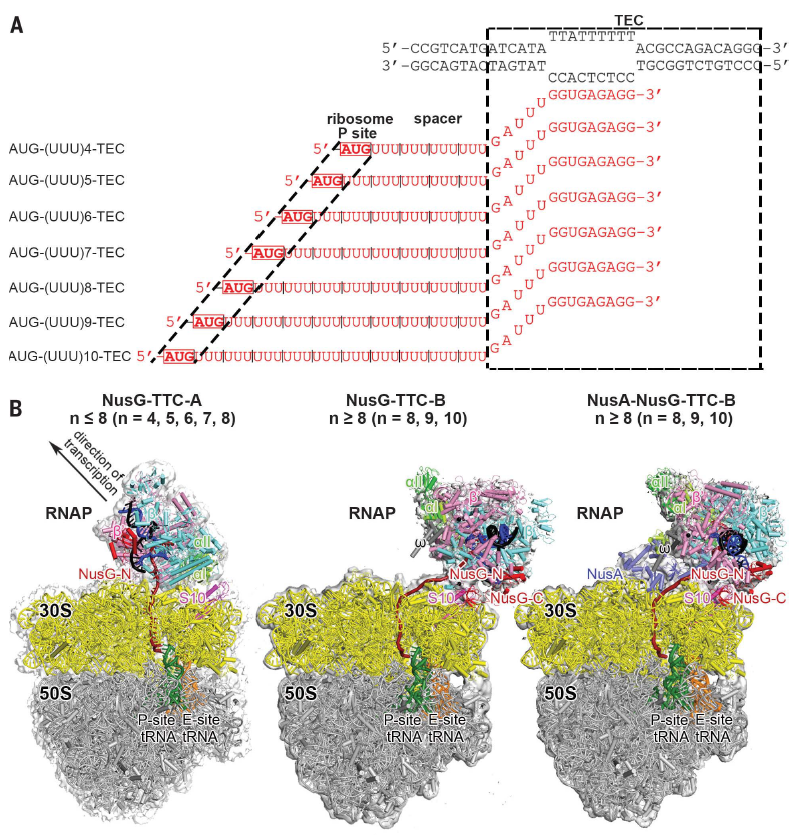
通过结构模拟,作者进一步发现,另一转录因子NusA也可能与TTC-B结合。因此尝试并最终解析了NusA-NusG共同调控的转录翻译协同复合体结构。此构象与NusG-TTC-B类似:在此构象中,信使RNA从核糖体S3亚基表面延申进入核糖体;具有完整的NusG电子云,并且由N端结构域与RNA聚合酶结合,C端结构域与核糖体S10亚基结合;具有完整的NusA电子云,NusA与核糖体S2/S5亚基结合,并同时结合RNA聚合酶a亚基CTD结构域。最终通过NusG, NusA的同时作用,进一步稳定了转录翻译协同过程。
综合上述结果,作者阐明了大肠杆菌中转录翻译协同过程的结构基础和分子机理,证明了NusG, NusA转录因子在协同过程中的重要作用,同时为进一步研究在转录翻译协同过程中可能的其他机制提供了可行的方法。

Science杂志同期还报道了法国斯特拉斯堡大学(Université de Strasbourg)Albert Weixlbaumer教授研究团队题为 Structural basis of transcription-translation coupling and collision in bacteria 的研究论文。该研究团队解析了大肠杆菌中,信使RNA spacer为5.67和7密码子长度,依赖NusG转录因子调控的转录翻译复合体结构,得到了与Richard Ebright研究团队类似的研究结论。

而在今年7月31号,Science还发表了德国柏林技术大学(Technische Universität Berlin)Julia Mahamid和Juri Rappsilber教授研究团队题为 In-cell architecture of an actively transcribing translating expressome 的研究论文。该研究团队通过冷冻断层扫描技术,解析了在肺炎支原体细胞中,依赖NusA转录因子调控肺炎支原体细胞中存在的转录翻译协同复合体结构。有趣的是,在此结构中,RNA聚合酶与核糖体的相对位置同Ebright及Weixlbaumer教授研究团队的结果并不一致,整体构象与“expressome”类似。
正如加州伯克利大学的Jamie Cate教授评论这一系列新的转录翻译协同复合体结构所说,这些新的结构极大的推进了转录翻译协同过程这一研究领域,但对于协同过程的研究还远远没有结束(“This convergence of new structures is definitely taking the field to another level, But it’s far from the end of the story”)。
来源:BioGossip BioArt
原文链接:https://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652498542&idx=1&sn=83e7b3d042f31b8a80bea13065416cc8&chksm=84e279dab395f0cc1496e0ce0df88b4efc2c7e0cd17a34e680b0158b70b58282edf85f585cf8#rd
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

Science新知:癌细胞可以改变核糖体,促进转移
核糖体RNA
【前沿进展】植生所唐威华研究组发现参与导致小麦赤霉病的新分子

朱健康团队综述 | 化繁为简,植物多基因编辑体系的优化
翻译组调控再显奇功:大幅改善毕赤酵母外源蛋白质表达的折叠效率

植物所科研人员揭示叶绿体核糖体RNA甲基化修饰的机制和功能

Cell子刊:延长寿命新机制,通过抑制线粒体核糖体翻译,来减慢胞质核糖体翻译

调控核糖体前体加工和组装的分子机制

没有细胞,怎么养核糖体?
生物物理所发现宿主抑制病毒蛋白质合成重编码的新机制