科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-05-30
来源:BioArt
2型糖尿病(Type 2 diabetes mellitus, T2D)是一种全球范围内发病广泛的慢性代谢疾病,患者特征表现为高血糖、胰岛素分泌功能受损以及胰岛素抵抗等【1】。近年来,随着人口老龄化与生活方式的变化,糖尿病在我国也从一个少见病演变为流行病,患病率从1980年的0.67%飙升到2013年的10.4%【2】。前驱糖尿病(中间型高血糖)发展为2型糖尿病的风险较高,每年约有5-10%的前驱糖尿病患者会发展为糖尿病,整体上约70%的前驱糖尿病患者会罹患糖尿病。研究前驱糖尿病的发生与发展将有助于揭示早期糖尿病的发病机理,并明确其对生命活动和患者健康的影响。2019年5月30日,来自斯坦福大学医学院的Michael Snyder教授联合Jackson基因组医学实验室George Weinstock教授领导团队在Nature杂志发表长文Longitudinal multi-omics of host–microbe dynamics in prediabetes,利用多组学深度测序手段,揭示了健康人群与前驱糖尿病患者的代谢与生理差异。

作者在4年内每3个月对106位受试者进行健康走访,采集了受试者健康状态及生病状态下的血液、粪便和鼻拭子样本,并将血液样本分离为外周血单核细胞(peripheral blood monocytes,PBMCs)、血浆和血清。每位受试者在此期间均进行了一次外显子测序,并在每次采样时对PBMCs中的13379种转录产物,血浆样本中的722种代谢物和302种蛋白质,血清中的62种细胞因子和生长因子进行了测序和检测;此外,作者还利用16S测序技术对数千种肠道和鼻腔微生物群落及其预测基因进行了分析,并在每次健康走访时进行了51项临床实验室检测(图1a,b,c)。作者通过上述多组学分析得到了包括上百万分子和微生物检测指标的庞大数据集(图1d)。
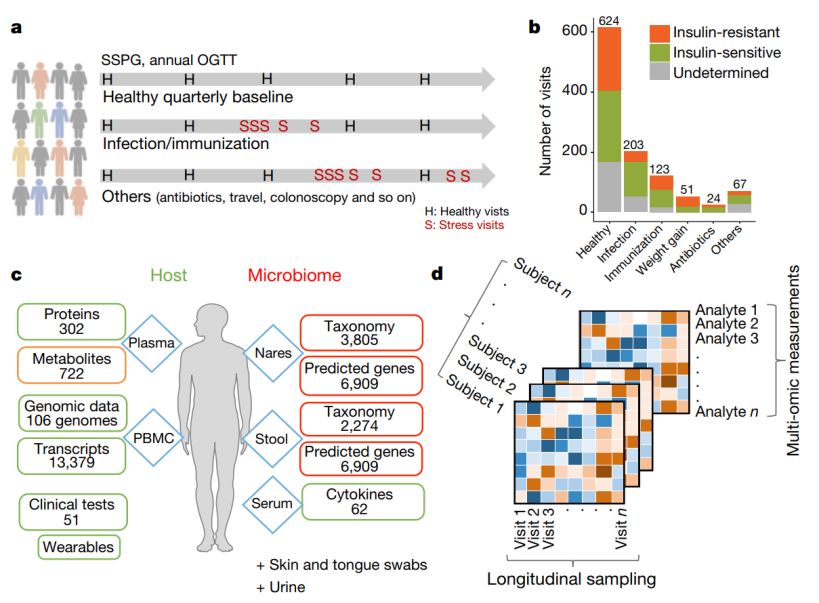
图1 研究设计、群组细节与实验数据
研究伊始,作者检测发现51位受试者患有前驱糖尿病,9位受试者患有糖尿病,66位受试者未发现医疗禁忌症(31位受试者属于胰岛素敏感型体质,35位属于胰岛素抵抗型体质)。通过对健康样本进行组内相关性分析,作者发现临床实验室检测数据和细胞因子个性化差异最为显著,而转录本在各个样本间差异不大;个体间肠道微生物群落的差异性要比肠道微生物预测基因的差异性更为显著。此外,作者检测了时间对健康样本个体间差异的影响,发现宿主分子与肠道微生物均与时间存在显著的相关性,一些肠道微生物种属随时间逐渐减少。
由于许多受试者具有胰岛素抵抗特征,作者进行了稳态血浆葡萄糖值的回归分析以及胰岛素抵抗和胰岛素敏感受试者共相关分析,以鉴定胰岛素抵抗的相关因子。结果发现,胰岛素抵抗与较高的炎症水平和脂质代谢改变有关,这可能导致胰岛素抵抗受试者对额外压力的反应失调。
作者检测了呼吸道病毒感染(respiratory viral infections,RVI)对受试者体内分子通路的影响,发现众多转录本、细胞因子、代谢物、蛋白、肠道微生物类群、鼻腔微生物类群和临床试验检测指标在个体间差异显著,作者基于这些差异进行了通路分析,发现与防御反应有关的分子通路,如白介素信号通路、mTOR信号、B细胞和T细胞受体信号通路等差异显著。此外,作者还鉴定到了一些之前被忽视的在RVI中失调的通路,如神经通路(亨廷顿舞蹈症通路和神经炎症信号通路)和代谢通路(胰岛素受体信号通路、肥胖人群瘦素信号转导通路和心肌肥厚通路)。因此,在病毒感染过程中会发生大量的生物学通路的变化。
作者随后确定了在RVI过程中上调或下调的四个主要时间分子簇,及其最相关的生物学通路、微生物群落和临床实验室数据。发现RVI过程中超敏C反应蛋白(high-sensitivity C-reactive proteins,HSCRPs)和白细胞计数升高,高密度脂蛋白(high-density lipoprotein,HDL)下调。一些肠道微生物和鼻腔微生物菌群也发生了变化,其中一些变化菌群(如厚壁菌门和臭杆菌属)之前研究中发现在炎症和RVI病人肠道中丰度降低【3, 4】,而鼻腔菌群随着RVI过程中病毒载量的增加呈现略微增加或延迟的趋势。
作者进一步比较了胰岛素抵抗型与敏感型受试者对RVI的反应,发现胰岛素抵抗的受试者体内各种分子受RVI影响更小,并且其鼻腔微生物种群变化不大,而胰岛素敏感受试者体内免疫信号通路会发生上调。作者推测这可能是由于胰岛素抵抗受试者基底炎症水平升高以及免疫反应异常导致的,这会潜在阻碍病毒和细菌在感染期间的协调性。作者认为RVI可能会增加胰岛素抵抗受试者发生T2D等代谢紊乱的风险,并且这些受试者对RVI的免疫反应受损。
作者继续分析了流感疫苗接种对不同受试者的影响,发现虽然疫苗接种后的通路富集情况与RVI类似,但两者间在一些重要的免疫信号通路上仍存在一些差异,且1型糖尿病(T1D)、T2D、胰岛素受体信号通路疫苗接种后发生下调。此外,受到RVI和疫苗接种影响,分别有11个和6个肠道微生物菌群失调,疫苗接种后与肥胖和高脂吸收有关的菌群发生下调,暗示了疫苗接种可能会降低T1D和T2D的风险。上述实验揭示了RVI和疫苗接种后分子通路变化的广泛差异,并鉴定到了与免疫反应、代谢和神经通路等有关的失调分子通路,与此同时肠道和鼻腔微生物稳态也发生了变化。
利用多组学数据,作者比较了健康状态与RVI或免疫接种间的差异情况,发现多组学手段能较好地在健康时间点中区分出RVI,且多组学和代谢组标记物能精确地在健康时间点中区分出免疫接种时间点。因此,与单一组学相比,多组学技术能更好地从健康时间点中筛选出病毒感染或疫苗接种等压力刺激事件,表明不同的组学数据在检测影响宿主生理状态发生变化的分子过程方面具有互补性。
人类宿主和微生物中同时检测到上千个多组学分子,本研究提供了鉴定分子与通路之间关联的可能性,并将其在胰岛素敏感和胰岛素抵抗的受试者之间进行比较,从个体和群体两个水平阐释其关联。
在个体内相关分析中,研究者重点阐释了肠道微生物与其他宿主之间的内在组学关联,以了解胰岛素敏感组和胰岛素抵抗组之间的差异。作者发现每组分析的平均关联数没有显著差异,胰岛素敏感的受试者与胰岛素抵抗者相比有不同的分析数关联。这种胰岛素抵抗特异性和胰岛素敏感特异性的相关性表明,两组肠道微生物具有不同的相互作用模式。
作者进一步分析了肠道微生物与宿主代谢物之间的关系。其中,在肠道微生物和宿主循环细胞因子之间的相关性分析中发现5种重要的胰岛素敏感特异性关联,例如仅在胰岛素敏感受试者中发现,Barnesiella属与IL-1β呈正相关,Faecalibacterium属与TNFA呈负相关。而这种关联性在胰岛素抵抗受试者中并不存在,表明胰岛素抵抗可能影响肠道微生物与宿主细胞因子之间的相互作用。此外,仅在胰岛素抵抗受试者中发现,Butyricimonas属与四种脂质负相关,表面特定菌与脂质代谢具有相关性。综上,这些发现表明在胰岛素敏感和胰岛素抵抗受试者中,肠道微生物与宿主免疫和代谢存在不同的协调作用。

图2 T2D发病前受试者的个性化特征
对多基因组图谱的分析证实,每个受试者个体都有一组不同于队列平均水平的独特分子。其中一名受试者体内一系列代谢物和细胞因子水平与队列平均水平相比出现异常,结果最后一次健康走访10个月过后,该受试者被诊断为T2D,而本研究多组学分析数据显示该受试者T2D通路异常,其白细胞介素-1受体拮抗剂(IL-1RA)和HSCRP水平在T2D确诊前的最后三次健康走访中高度上调(图2)。作者在与IL-1RA高度相关的分子中发现了一些外源物质,如肠道微生物中与葡萄糖耐受失调有关的代谢产物——甲基尿酸和甲基黄嘌呤【5】。这些外源物质也与补体系统、急性免疫应答信号以及LPS刺激的MAPK通路密切相关,而这些通路恰好是影响糖尿病发生的重要通路。此外,在该受试者T2D确诊之前,作者发现其肠道微生物多样性下降,体重增加。因此,通过检查该受试者T2D发生过程中的多组学检测数据,作者确定了数百个先于疾病确诊而变化的分子,这些分子很可能与该受试者T2D的发生机制具有潜在的相关性。
综上所述,本研究运用多组学测序手段,揭示了在健康状态下和疾病发生时葡萄糖代谢失调个体和健康个体间生物学通路和生理反应的差异性,并为进一步研究健康状态、前驱糖尿病状态和T2D状态的区别与内在联系提供了一个开源的数据库。后续研究将有助于在群体和个人水平上更进一步了解多组学因子如何影响人类健康,并确定其在疾病发生早期是如何变异的,以防病于未然。
原文链接:
https://doi.org/10.1038/s41586-019-1236-x
参考文献
1. Weyer C. et al. The natural history of insulin secretory dysfunction and insulin resistance in the pathogenesis of type 2 diabetes mellitus. The Journal of clinical investigation, 1999, 104(6): 787-794.
2. 中华医学会糖尿病学分会. 中国 2 型糖尿病防治指南 (2017年版) . 中华糖尿病杂志, 2018, 10(1): 4-67.
3. Moon, C. & Stappenbeck, T. S. Viral interactions with the host and microbiota in the intestine. Current Opinion in Immunology. 2012, 24: 405–410.
4. Groves, H. T. et al. Respiratory disease following viral lung infection alters the murine gut microbiota. Frontiers in Immunology 2018, 9: 182.
5. Zhao, X. et al. Metabonomic fingerprints of fasting plasma and spot urine reveal human pre-diabetic metabolic traits. Metabolomics, 2010, 6: 362–374.
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652470606&idx=5&sn=b4322db098358373298dc75bcdf4651d&chksm=84e2eefab39567ecb3937d7c637b10e43cf1c9b6b03a100f06bc91091f430d9f40e49dcf097b&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
胰岛素 糖尿病 肠道菌群 微生物 Nature 疫苗接种 胰岛素抵抗
2017年中国药学会药学网络大讲堂(第六期)-慢病治疗与管理专场三在广州举行




咖啡豆副产物,或能减轻细胞炎症和胰岛素抵抗

科学家发现炎症致胰岛素抵抗及糖尿病的新机制

【阐释】胰岛素抵抗与妊娠期糖尿病

腰身胖、痘痘多,胰岛素抵抗,应当怎么吃呢?

《细胞》子刊:补觉无法弥补缺少的睡眠,还会破坏昼夜节律

【综述】皮下胰岛素抵抗的病因和治疗

Science Advances|陈帅课题组发现2型糖尿病治疗新靶点

Science:靶向神经酰胺双键可改善胰岛素抵抗和脂肪肝

营养与健康所发现乳酸参与调控肥胖导致的胰岛素抵抗