科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-06-03
来源:iNature
流感病毒是一种严重的病原体,威胁着全球公共健康并感染人类和动物种群。在上个世纪,已经记录了四次流感大流行导致许多人死亡:1918年和2009年的H1N1,1957年的H2N2,以及1968年的H3N2。具有广泛中和人单克隆抗体的分离为甲型流感病毒感染者的治疗到来了希望。大多数针对甲型流感病毒的广泛中和抗体结合保守的茎区或血凝素的受体结合腔,并且相互作用由重链支配。然而,轻链对抗原的作用很小或没有直接接触。进一步的结构研究表明,轻链通过影响重链的局部构象来调节中和谱,而不是与抗原直接相互作用。
近期,中科院天津工业生物技术研究所高福团队等人发表题为“Light chain modulates heavy chain conformation to change protectionprofile of monoclonal antibodies against influenza A viruses”的文章,发表在Cell Discovery上。该文章为理解抗原识别中轻链的分子基础提供了重要线索,并探索了特别是使用轻链修饰来开发针对甲型流感病毒和其他新兴病毒的广泛保护性单克隆抗体的策略。
另外,2019年5月16日,中国科学院微生物研究所病原微生物与免疫学重点实验室高福,首都医科大学附属北京儿童医院谢正德及北京大学魏文胜共同通讯在Cell 在线发表题为“Human Neonatal Fc Receptor Is the Cellular Uncoating Receptor for Enterovirus B”的研究论文,该研究通过CRISPR-Cas9文库筛选鉴定新生儿Fc受体(FcRn)作为大量EV-B病毒的通用脱壳受体。通过FcRn修饰的脂质体实验证实FcRn介导的脱壳作用。 另外,在中性和酸性pH条件下确定了apo形式的Echo 6病毒的一系列高分辨率低温-EM结构,并且与其附着受体CD55或未包被受体FcRn复合。 通过比较这些结构,该研究系统地剖析了Echo 6附着和脱壳受体的不同作用,这为理解肠道病毒进入的机制提供了结构基础。发现FcRn作为其受体将改善基于艾柯病毒的溶瘤治疗剂的开发(点击阅读)。
另外,2019年5月9日,中国科学院微生物研究所病原微生物与免疫学重点实验室高福及中国科学院天津工业生物技术研究所Gao Feng共同通讯在Cell 在线发表题为“Molecular Basis of Arthritogenic Alphavirus Receptor MXRA8 Binding to Chikungunya Virus Envelope Protein”的研究论文,该研究研究人员报告了游离小鼠MXRA8(mMXRA8)的晶体结构和人MXRA8(hMXRA8)与CHIKV E蛋白之间的复合物的冷冻电子显微镜结构。 MXRA8具有两个具有独特结构拓扑的Ig样结构域。该受体在病毒体表面上的E尖峰的两个原体之间的“峡谷”中结合值得注意的是,MXRA8的茎区对于CHIKV病毒进入至关重要。该发现提供了关于针对那些致关节炎性甲病毒的治疗对策的发展的重要信息(点击阅读);

全世界都有严重的季节性流感袭击,从中国到英国和美国,提醒我们再次面临潜在的流感大流行的威胁。值得注意的是1918年流感大流行,是历史上最具破坏性的大流行病。因此,目前的担忧是可以理解的。尽管可获得针对甲型流感病毒和乙型流感病毒(IAV和IBV)的疫苗,但由于流感病毒株的包膜蛋白(血凝素,HA;神经氨酸酶,NA)的快速抗原性变异,它们提供的保护是有限的,在人群中没有预先存在的针对此类突发病毒的免疫力,并且可用的疫苗不能防止这种病毒株。因此,迫切需要通用疫苗和治疗性抗体来抵抗那些快速变化的流感病毒。
为了确定AF4H1K1识别的表位,研究人员确定了AF4H1K1 Fab与1968 H3N2大流行分离株(H3-AC / 68)和H4N6鸭分离株(H4-CZ / 56)的复合物的晶体结构。和3.8Å分辨率(补充表S4)。两种配合物的总体结构非常相似。 AF4H1K1 Fab片段以相似的方向结合茎和残留 - 酯酶结构域的H3HA和H4HA,其中Fab分子与HA茎大致正交。在两种复杂结构中,重链主导与HA分子的相互作用。 AF4H1K1重链的结合足迹涉及HA1和HA2亚基,而轻链只接触HA2亚基的两个氨基酸Gln42和Asp46,它们也参与重链相互作用。在AF4H1K1重链中,重链CDR1(HCDR1),HCDR2,HCDR3和重链框架区3(HFR3)环参与H3和H4 HA分子的相互作用。相比之下,只有轻链CDR1(LCDR1)的Ser30,Ser31和Tyr33以及LCDR3的Gly93有助于H3 HA表位识别,而LCDR3环不参与识别H4分子。
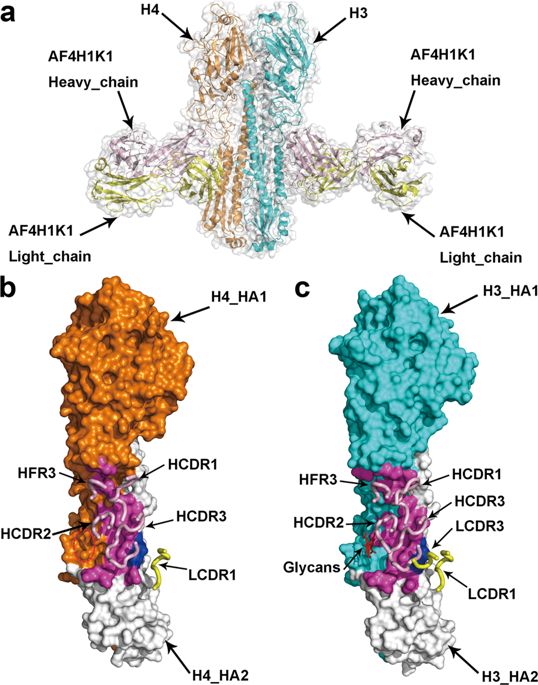
获得了可以中和H3N2 IAV的huMAbAF4H1K1后,在体外测试了其对IAV其他亚型的中和活性。 结果显示AF4H1K1可以中和H3-进化枝IAV,包括H3,H4和H14,50%抑制剂浓度(IC50)从13.2μg/ml排列至189.0μg/ ml。 AF4H1K1可识别在第2组IAV感染的细胞表面中表达的所有HA蛋白亚型,但不识别在第1组IAV感染的细胞中呈递的HA蛋白(补充图S1c)。 AF4H1K1以高亲和力结合大多数第2组HA,对于H3,H4,H14,H7和H10HA分别具有4pM至49nM的KD值。 相比之下,AF4H1K1对H15HA的亲和力低得多。
以前的研究表明,某种重链与一系列轻链配对可能导致对抗原23,31,32,33的结合亲和力的变化,甚至改变中和活性。还提示反组1和组2 IAV bnMAb的重链和轻链的交换可导致抗原结合活性的消除。然而该研究尚未表征结构基础,在这里,作者的研究首次发现:通过调节配对重链的构象,轻链可以促进结合和中和谱。研究结果增强了对分子水平上bnMAb对IAV保护特性的轻链贡献的理解,并为通过靶向轻链来设计更强大的bnMAb提供了机会。
原文链接:https://www.nature.com/articles/s41467-019-09566-3
来源:Plant_ihuman iNature
原文链接:http://mp.weixin.qq.com/s?__biz=MzU3MTE3MjUyOA==&mid=2247501713&idx=5&sn=5f024f9fbbbf740b9421885c6b521068&chksm=fce6b44ecb913d581d89b806d5095436c6088d0e7b5d53c94c1b4574b299871b6e5f00c773ff&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
研究透视:Cell综述-水凝胶
Cell揭密神奇的肠道细菌
浙大34岁“歌神教授”:科研也是在创造艺术品




Cell :噬菌体抗菌疗法开发
Cell:父系行为如何受到调控?
Cell Stem Cell | m6A阅读蛋白YTHDF2在白血病中的功能研究
Cell Stem Cell | 辛利组揭示微环境调控前列腺干细胞增殖的机制

Cell Stem Cell | 骨骼肌干细胞如何应对环境污染物刺激?
mTORC2控制线粒体膜通透性,调节自噬流量并影响寿命长短

Cell Stem Cell:中南大学林戈等揭示不同亲本对人类植入前发育的影响