科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-06-18
来源:BioArt
传统小分子药物发挥作用的机理多为阻断靶蛋白的功能,例如酶抑制剂可抑制酶的催化反应,受体拮抗剂可阻断受体介导的信号通路。然而许多蛋白很难通过传统小分子药物来抑制其功能,例如有些蛋白有多个动能区域,单一的抑制其中一个功能区域往往不能完全阻断蛋白介导的生物学功能。近些年来,一类小分子(蛋白降解剂)可介导泛素化连接酶与靶蛋白的识别,从而通过完全降解靶蛋白来达到阻断蛋白功能的目的【1-4】。目前蛋白降解剂主要分为两类,一类被称为“分子胶水”(”molecular glue”),其通过修饰泛素化连接酶的特定区域或位点使其拥有识别并降解全新底物(neo-substrate)的特性【5】,例如免疫调节剂沙利度胺(thalidomide)和磺胺类抗肿瘤药(Indisulam);另外一类为双功能分子(bifunctional compound),又称为蛋白水解靶向嵌合体(Proteolysis-Targeting Chimeras, PROTACs)【6】,其通过一段具有不同长度的连接分子(linker)将泛素化连接酶和靶蛋白的配体连接起来从而达到使泛素化连接酶识别并降解特定底物的功能。
蛋白降解剂具有很大的发展成为一类新颖药物的潜力。例如,作为催化分子,蛋白降解剂其可通过相对较低的浓度达到阻断靶蛋白的目的,从而大大降低了脱靶效应。人体内有大于600个泛素化连接酶,其中有两个(CRBN和VHL)被系统地研究并用于设计蛋白降解剂【7】。虽然通过这两个泛素化连接酶设计的蛋白降解剂取得了很大成功,但是该分子设计思路仍具有一定局限性,例如,一些研究表明即便在蛋白降解剂存在的情况下,这两个泛素化连接酶仍具有靶蛋白选择性。另外,最近一项研究表明细胞会通过突变或敲除泛素化连接酶使其对基于这两个泛素化连接酶设计的蛋白降解剂产生抗药性。这些局限性说明我们需要发现新的可用于设计蛋白降解剂的泛素化连接酶,从而进一步扩大该技术的应用。
美国Scripps研究所的Benjamin Cravatt实验室最近几年发表的一些工作通过共价片段分子去寻找并鉴定人类蛋白组中具有成药潜力的半胱氨酸位点。这些工作鉴定出了一些被作者称为“侦探”类的分子(scout fragment),其可最大程度的结合暴露在蛋白表面并具有成药潜力的半胱氨酸位点,这其中包括了很多从未被研究过的泛素化连接酶。
2019年6月17日,Benjamin Cravatt团队(第一作者和共同通讯作者为张潇雨博士)继续在Nature Chemical Biology杂志上发表文章Electrophilic PROTACs that degrade nuclear proteins by engaging DCAF16。

在该工作中,作者首先提出一项假设:将这些“侦探”类分子与另外一个专一性配体连接起来,去寻找潜在的可以降解配体结合底物的泛素化连接酶。作者首先选择了在蛋白降解剂领域被广泛使用的一个蛋白(FKBP12)和其专一性配体(SLF),并将其与三种不用的“侦探”类分子(KB02,KB03和KB05)连接。
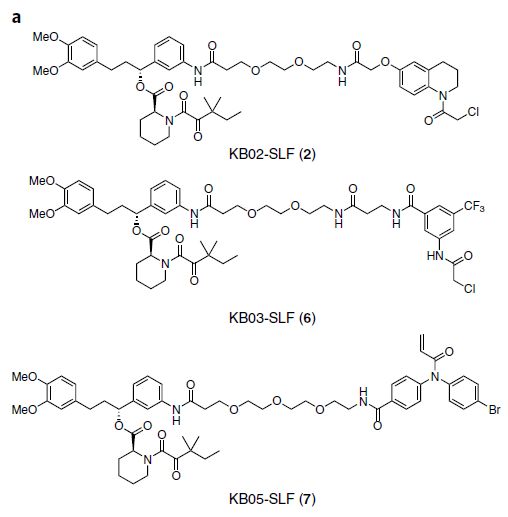
细胞中有存在于细胞质以及细胞核里的两套泛素化蛋白质降解系统。为了去分别研究这两套系统,作者建立了两种细胞模型去表达只存在于细胞质以及细胞核中的FKBP12。作者发现其中一个双功能分子(KB02-SLF)可特异性的降解细胞核中的FKBP12但对存在于细胞质中的FKBP12没有影响。之后作者通过使用类泛素化修饰(Neddylation)特异性抑制剂(MLN4924)以及与非共价对照化合物的对比,确定了这个双功能分子通过与半胱氨酸的共价反应结合了一个细胞核中的Cullin-Ring Ligase类泛素化连接酶。
随后作者通过富集靶蛋白并结合蛋白质组质谱分析的方法鉴定出了该泛素化连接酶(DCAF16)。在DCAF16敲低和敲除的细胞中,该双功能分子不再降解细胞核中的FKBP12。DCAF16是一个几乎没有被研究过的,在啮齿动物中缺失的泛素化连接酶,其功能以及内源性降解底物目前都没有相关文献报道。
作者通过对纯化蛋白的质谱分子确定了该双功能分子修饰了DCAF16一个具有连续三个半胱氨酸的区域(Cys177-179)。通过点突变实验,作者发现当半胱氨酸177和179突变为丝氨酸(从而丧失了共价结合化合物的能力),DCAF16不再支持由该双功能分子引起的FKBP12降解,这说明半胱氨酸177和179极有可能为产生其降解靶蛋白功能的关键位点。随后作者将KB02与BRD4蛋白特异性配体JQ1连接并合成一个新的双功能分子(KB02-JQ1)。该双功能分子能降解内源性BRD4,当DCAF16被敲除的后,KB02-JQ1不再降解BRD4。最后,作者利用蛋白质活性表达技术(ABPP)确定了KB02-SLF和KB02-JQ1分别通过修饰大约10%和40%和DCAF16来达到降解靶蛋白的目的。
这项工作在被广泛研究的两个泛素化连接酶(CRBN和VHL)的基础上进一步扩大了蛋白降解剂的应用前景。首先,与CRBN和VHL相比,DCAF16特意性地降解细胞核中的蛋白。该特性可提高未来蛋白降解剂的特异性并减少脱靶效应。其次,该工作中报道的两个双功能分子只需结合一小部分DCAF16即可产生明显的降解效应,这说明利用DCAF16设计的蛋白降解剂会很大程度上减少甚至不会影响DCAF16对其内源性底物的作用,因为这些底物仍然会被没有被蛋白降解剂修饰的DCAF16所调节。
总之,目前基于CRBN和VHL的蛋白降解剂均为非共价结合分子,在分子设计时需要考虑两个不同的分子和蛋白结合区域的动力学问题。该共价蛋白降解剂通过共价修饰DCAF16半胱氨酸把系统简化成了只需考虑一个分子和蛋白结合区域的动力学问题,从而可能会设计出更有效的,被细胞更缓慢代谢并清除的蛋白降解剂。
原文链接:
https://doi.org/10.1038/s41589-019-0279-5
制版人:小娴子
参考文献
1. Cromm, P. M. & Crews, C. M. Targeted proteindegradation: from chemical biology to drug discovery. Cell Chem. Biol. 24, 1181–1190(2017).
2. Lebraud, H. & Heightman, T. D. Proteindegradation: a validated therapeutic strategy with exciting prospects. EssaysBiochem. 61, 517–527 (2017).
3. Bondeson, D. P. & Crews, C. M. Targeted proteindegradation by small molecules. Annu. Rev. Pharmacol. Toxicol. 57, 107–123(2017).
4. Collins, I., Wang, H., Caldwell, J. J. &Chopra, R. Chemical approaches to targeted protein degradation throughmodulation of the ubiquitin-proteasome pathway. Biochem. J. 474, 1127–1147(2017).
5. Hughes, S. J. & Ciulli, A. Molecularrecognition of ternary complexes: a new dimension in the structure-guideddesign of chemical degraders. Essays Biochem. 61, 505–516(2017).
6. Zorba, A. et al. Delineating the role ofcooperativity in the design of potent PROTACs for BTK. Proc. Natl Acad. Sci.USA 115, E7285–E7292 (2018).
7. Han, T. et al. Anticancer sulfonamides targetsplicing by inducing RBM39 degradation via recruitment to DCAF15. Science 356, eaal3755(2017).
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652471388&idx=4&sn=f787429c7c47a8c18c494794ec4af21d&chksm=84e213e8b3959afe55603008052564aed9ae8c73e1f6ca34bfa4448ba08a3bdca94743a6ac25&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
病原菌特异性地切割宿主线性泛素链的全新去泛素化酶的发现
失去细胞核的细胞在3D环境中举步维艰
许杰组报道PD-L1棕榈酰化修饰及相应的抑制剂开发策略
N-叔丁氧羰基-S-三苯甲基-L-半胱氨酸
美科学家展示了细胞核内部DNA的3D图谱

Cell :半胱氨酸毒性导致衰老相关线粒体减少
L-半胱氨酸盐酸盐一水物

这个“副作用”能救命!卵巢癌耐药问题有新解
DL-半胱氨酸盐酸盐

急性哮喘发作可用乙酰半胱氨酸祛痰?