科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-06-24
来源:BioArt
在蛋白质翻译过程中,核糖体停滞会导致其组件处于不活跃状态,并产生不成熟的、具有潜在生物毒性的新生多肽。因此,所有生物体都具有专用的机制,以感知核糖体停滞并介导其组件的循环和新生多肽链的水解[1]。因为其重要作用,这种机制的障碍会影响细胞的健康成长并导致哺乳动物出现神经退行性病变[2]。
在细菌中,ssrA/tmRNA(transfer-messenger RNA, tRNA和mRNA的混合分子)是感知停滞核糖体的经典系统[3]。在停滞的核糖体中,tmRNA能够在核糖体的A位结合mRNAs,其中,tmRNA中的mRNA部分能够让核糖体恢复转运,而携带丙氨酸的tRNA则接受新生多肽链的延伸。恢复运行的tmRNA阅读框能够编码大约8-35个氨基酸残基的多肽链(在枯草芽孢杆菌中为15个),这一段多肽链连接到新生多肽链的C端,起到了决定子的作用,它能够招募CIpXP和其他蛋白酶[4]。
tmRNA系统是真细菌专有的感知核糖体停滞的系统,在真核细胞中,核糖体停滞能够被“拯救”因子感知,比如Pelota/Dom34和ABCE1/Rli1,它们能够促进核糖体分裂,释放携带着新生多肽链以及tRNA的60S亚基。这个大的复合体是核糖体相关蛋白质量控制(ribosome-associated protein quality control, RQC)的底物,而Rqc2/NEMF能够感知这个底物并招募E3连接酶Ltn1/Listerin,最终将新生多肽链泛素化并通过蛋白酶体途径降解[5]。另外,在酵母菌中的研究显示,当Ltn1无法找到合适的泛素连接位点时,Rqc2能够招募丙氨酸tRNA和苏氨酸tRNA,然后在新生多肽链C端延伸出一段由丙氨酸和苏氨酸组成的尾巴(C-trminal Ala and Thr tail, CAT tail),它能将新生肽链中隐藏的赖氨酸位点暴露给Ltn1,导致新生肽链的泛素化降解[6]。
在RQC中,Rqc2的活性和Ltn1是紧密相关的,但是,Ltn1是真核细胞专有的,而Rqc2的同源基因在细菌和古细菌中都有发现,说明Rqc2的祖先基因已经存在于最后的共同祖先(the last universal common ancestor, LUCA)体内。那么,在原核生物中Rqc2的同源基因是否同样能够起到感知核糖体停滞的作用呢?
近日,来自海德堡大学的Claudio A.P. Joazeiro研究组在Cell期刊以“Alanine TailsSignal Proteolysis in Bacterial Ribosome-Associated Quality Control”为题,对原核生物中核糖体相关质量控制做了研究,发现细菌Rqc2的同源基因产物RqcH能够促进由核糖体停滞导致的新生多肽链的降解,而且,这种存在于原核生物中的多肽链降解方式是不同于真细菌体内的全新的方式。

研究人员首先利用生物信息学分析了不同物种中Rqc2同源蛋白的结构情况,发现Rqc2的同源蛋白存在于所有物种中,且它们都具有相似的结构特征,说明这些同源蛋白可能具有相同或者类似的功能,在RQC过程中起到了重要的作用。
在枯草芽孢杆菌中,利用免疫共沉淀实验,研究人员发现Rqc2H(Rqc2 homolog)能够选择性且专一性的与核糖体的50S亚基中的蛋白和rRNA结合,而不与30S亚基相应组分结合,冷冻电镜分析Rqc2H与核糖体50S亚基复合物的结构也证实了它们之间的结合作用。
之前有研究报道,在酵母菌中Rqc2能够特异性的结合丙氨酸tRNA和苏氨酸tRNA以延伸出CAT尾巴多肽,其中,Rqc2上的一些保守氨基酸对于CAT的形成至关重要。与之类似,研究人员发现Rqc2H中一些相应氨基酸(Asp97/E121/I122/M123)的突变能够降低免疫共沉淀中与Rqc2H结合的tRNA的量,但并未影响其与50S亚基的结合,说明与Rqc2H结合的tRNA是特异的,且不需要50S亚基的参与。经过测序发现,与Rqc2H结合的tRNA是丙氨酸tRNA。
进一步实验证实,Rqc2H能够在新生多肽链的C端进行丙氨酸的寡聚化修饰,这种功能与Rqc2H和丙氨酸tRNA之间的结合密切相关,当Rqc2H上关键氨基酸(D97)突变影响了其与tRNA的结合时,也会影响新生多肽链C端寡聚丙氨酸链的延伸。接下来,研究人员通过实验证实,核糖体停滞产生的新生多肽链的水解需要丙氨酸尾巴的存在,而且,丙氨酸尾巴足以招募CIpP对新生多肽链进行降解。最后,研究人员发现,丙氨酸尾巴作为一种水解标签机制,能够保护细胞免受核糖体停滞造成的蛋白质合成障碍。
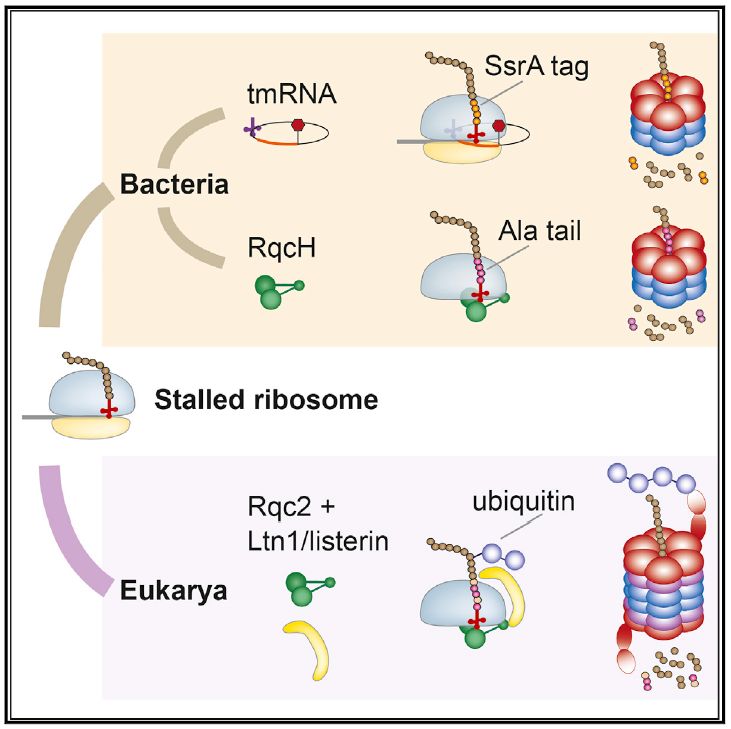
综上所述,本研究发现,在原核生物体内存在着感知核糖体停滞的系统,它的作用机制与真核生物以及真细菌体内的类似系统作用相同,但其具体机制并不相同。它能让细胞度过核糖体停滞带来的生存危机。本研究能够帮助我们深入理解生物体面对环境危机时的反应,理解生物进化过程中一些关键信号机制的演进过程。
原文链接:
https://doi.org/10.1016/j.cell.2019.05.002
制版人:小娴子
参考文献
1. Defenouille` re, Q., and Fromont-Racine, M.(2017). The ribosome-bound quality control complex: from aberrant peptideclearance to proteostasis maintenance. Curr. Genet. 63, 997–1005.
2. Chu, J., Hong, N.A., Masuda, C.A., Jenkins,B.V., Nelms, K.A., Goodnow, C.C., Glynne, R.J., Wu, H., Masliah, E., Joazeiro,C.A., and Kay, S.A. (2009). A mouse forward genetics screen identifies LISTERINas an E3 ubiquitin ligase involved in neurodegeneration. Proc. Natl. Acad. Sci.USA 106, 2097–2103.
3. Janssen, B.D., and Hayes, C.S. (2012). The tmRNAribosome-rescue system. Adv. Protein Chem. Struct. Biol. 86, 151–191.
4. Moore, S.D., and Sauer, R.T. (2007). The tmRNAsystem for translational surveillance and ribosome rescue. Annu. Rev. Biochem.76, 101–124.
5. Bengtson, M.H., and Joazeiro, C.A. (2010). Roleof a ribosome-associated E3 ubiquitin ligase in protein quality control. Nature467, 470–473.
6. Kostova, K.K., Hickey, K.L., Osuna, B.A.,Hussmann, J.A., Frost, A., Weinberg, D.E., and Weissman, J.S. (2017).CAT-tailing as a fail-safe mechanism for efficient degradation of stallednascent polypeptides. Science 357, 414–417.
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652471628&idx=4&sn=057359b251bdf005a21118ee084e3694&chksm=84e212f8b3959beed77cbba30bca85bc0706660e5040d6583dc03c988ef3dd1de290292f4ef2&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
原核生物 核糖体 多肽合成 核糖体rna 丙氨酸 核糖体结合位点
Angew封面:多肽修饰的铂纳米颗粒化身特异性肝癌杀手
生物物理所发现宿主抑制病毒蛋白质合成重编码的新机制

Mol Cell:程净东等揭示RNA外切酶体参与90s核糖体前体的切割
北理工梁建华团队在抗耐药菌药物研发上取得重要进展

我科学家打开“改造”生命的大门
王启刚教授:一步纳米表面自组装合成无泡基超声诊疗剂

同济大学王启刚教授团队在纳米界面多肽自组装成胶方面取得新进展
分子细胞卓越中心发现核仁新结构调控核糖体RNA末端加工机制
研究揭示叶绿体核糖体RNA甲基化修饰的机制和功能

我国科学家发现核糖体RNA“超级工厂”运行新机制