科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-07-12
来源:iNature
线粒体不仅产生ATP,还产生活性氧(ROS)和生物合成代谢物。线粒体还作为代谢信号中心起作用,通过激活细胞质信号传导途径和核基因表达来响应压力以调节多种细胞过程,包括增殖,分化,自噬和细胞死亡。线粒体功能障碍与代谢紊乱和相关疾病有关,例如神经退行性疾病,心肌病,代谢综合征,免疫疾病和癌症。响应代谢应激,调节线粒体中代谢酶的活性。先前的研究表明,线粒体乙酰化是广泛存在的,并且是线粒体蛋白质的重要调节机制。线粒体乙酰化主要由烟酰胺腺嘌呤二核苷酸(NAD)+依赖性脱乙酰酶sirtuin3(Sirt3)控制。在Sirt3敲除小鼠中,线粒体蛋白的乙酰化水平在各种组织中显着增加。线粒体中的其他sirtuin家族成员包括Sirt4和Sirt5。Sirt4具有脱乙酰化以及脱丙酰化和脱苄基化活性。Sirt5起到线粒体蛋白的去丙酰化,去琥珀酰化和去戊二酰化的作用。已显示包括磷酸化和SUMO化的翻译后修饰调节Sirt1活性。然而,通过转录后机制调节Sirt3蛋白仍然是未知的。我们的研究结果
2019年7月10日,上海交通大学医学院程金科团队等人在Molecular Cell上发表题为“SENP1-Sirt3 SignalingControls Mitochondrial Protein Acetylation and Metabolism”的文章,证明了SENP1-Sirt3信号在调节代谢应激过程中线粒体乙酰化和代谢中起着至关重要的作用。

线粒体蛋白的乙酰化水平主要受Sirtuin介导的去乙酰化控制。尽管Sirtuin家族成员Sirt3-Sirt5都位于线粒体中,但功能上Sirt3是线粒体中的主要去乙酰酶。在与Sirt3和SUMO1共转染但不与SUMO2/ 3共转染的细胞的线粒体部分中容易检测到SUMO化的Sirt3条带,在Sirt3 + / +的线粒体组分中也检测到内源SUMO化的Sirt3条带。研究人员通过SUMO化修饰 MS检测技术证实了K288在人Sirt3蛋白上的SUMO化。将赖氨酸288突变为精氨酸完全消除SirtP1的ScoP1的SUMO1缀合,但不是SENP1突变体,可以消除线粒体部分中SUMO1-缀合的Sirt3条带。总之,这些数据表明Sirt3是线粒体中的SUMO化蛋白质。
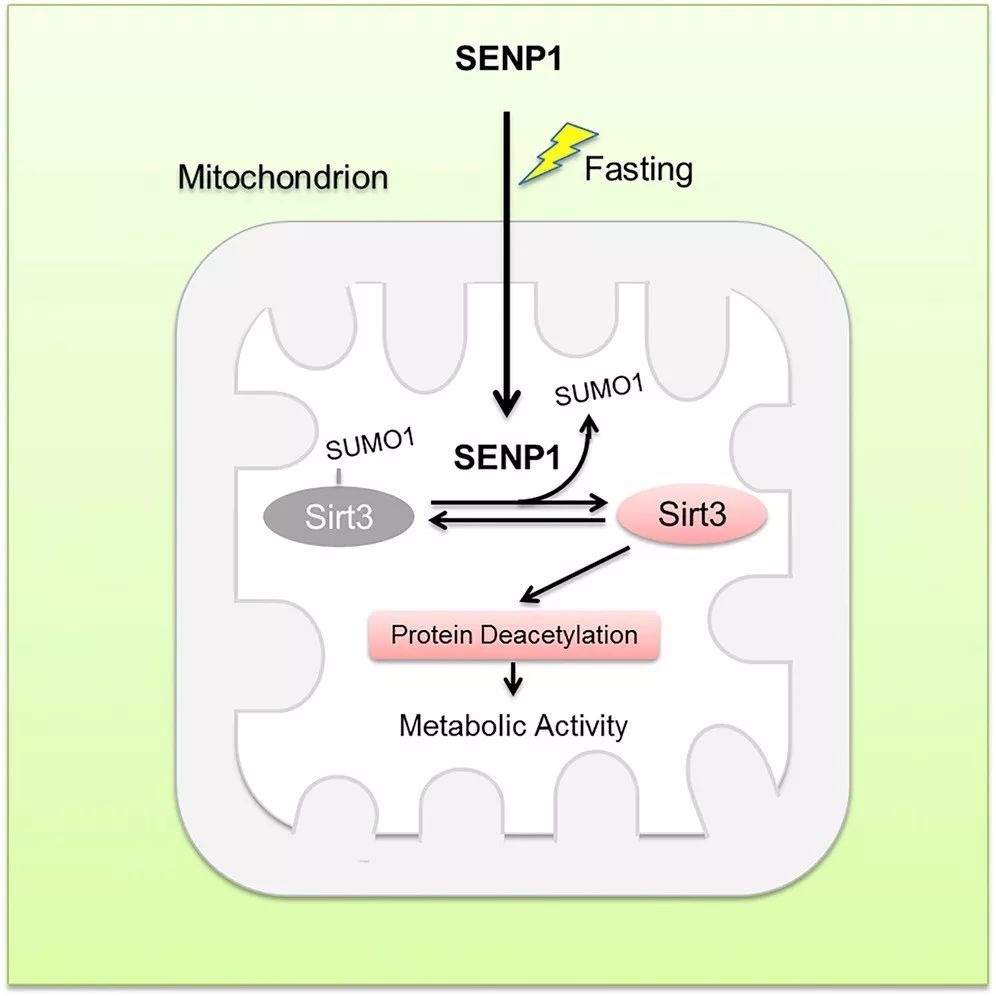
Sirt3作为主要的线粒体烟酰胺腺嘌呤二核苷酸(NAD)依赖性去乙酰化酶,是线粒体代谢适应各种应激所必需的。然而,如何调节响应代谢应激的Sirt3活性仍然是未知的。该研究报告了Sirt3是线粒体中的SUMO化修饰蛋白,SUMO化修饰抑制Sirt3催化活性。SUMO化修饰缺陷的Sirt3显示线粒体蛋白质的脱乙酰化升高和脂肪酸氧化增加。
在禁食期间,SUMO特异性蛋白酶SENP1在线粒体中积累并快速去SUMO化并激活Sirt3。SENP1缺陷导致Sirt3的超SUMO化和线粒体蛋白的高度乙酰化,这减少了响应于禁食的线粒体代谢适应。此外,还发现禁食诱导SENP1易位到线粒体中以激活Sirt3。对小鼠的研究表明,Sirt3 SUMO化修饰突变通过增加氧化磷酸化和能量消耗来减少脂肪量并拮抗高脂饮食(HFD)诱导的肥胖。研究结果表明,SENP1-Sirt3信号调节代谢应激过程中Sirt3的活化和线粒体代谢。
原文链接:
https://www.cell.com/molecular-cell/fulltext/S1097-2765(19)30441-1
来源:Plant_ihuman iNature
原文链接:http://mp.weixin.qq.com/s?__biz=MzU3MTE3MjUyOA==&mid=2247502764&idx=7&sn=0f867e5b998b07107fb75c378b69ee83&chksm=fce6b873cb91316533a63a5bc6b3c66db95d6ad2a3df4570c8e775af883b6787d5224536c6d2&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
焦虑与线粒体的隐秘关系
线粒体DNA
线粒体也能来自父亲

“长寿药”首次用到人类身上效果惊人?并非如此!

线粒体光学检测与调控|“儒谈线粒体”学术沙龙系列论坛第六讲

线粒体疾病发病机理阐明
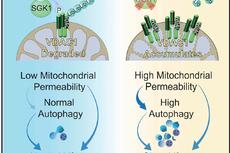
mTORC2控制线粒体膜通透性,调节自噬流量并影响寿命长短
1天同时发表4篇Cell Metabolism文章,中国学者在代谢领域取得新突破
线粒体应激调控衰老的机制研究|“儒谈线粒体”学术沙龙系列论坛第九讲
关于利用线粒体-溶酶体互作双标记探针揭示线粒体局部黏度响应的研究